Ваз 21074 электросхема: ВАЗ 21074 инжектор — схема электрооборудования с описанием, неисправности электросхемы
Электрическая схема автомобиля ВАЗ 21074 — wiCar
Главная » Электросхемы
Электросхемы
Автор kofa1 На чтение 5 мин Просмотров 119 Опубликовано
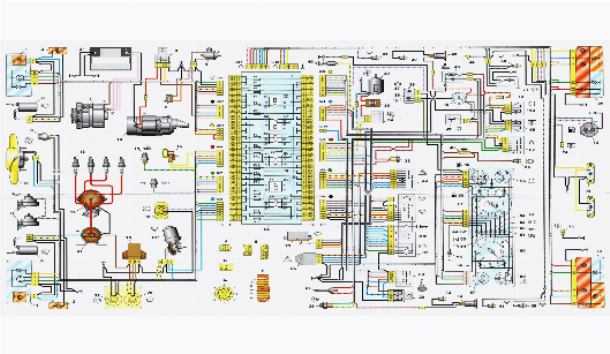
Качественная цветная схема электрооборудования легкового отечественного авто ВАЗ-21074 приводится в помощь автоэлектрикам и СТО. Модель 21074 представляет собой усовершенствованную модификацию ВАЗ-2107. На «семьдесят четверку» устанавливается тот же двигатель объемом в 1,6 л, но карбюратор заменен на инжектор. Некоторые элементы схемы устанавливаются не на все, а лишь на части выпускаемых автомобилей этой модели. В конце статьи показаны предохранители и защищаемые ими цепи. Схемы увеличиваются по клику.
Содержание
- Электрооборудование ВАЗ-21074
- Схема системы управления двигателем ВАЗ 21074
- Блок предохранителей Ваз-21074 инжектор
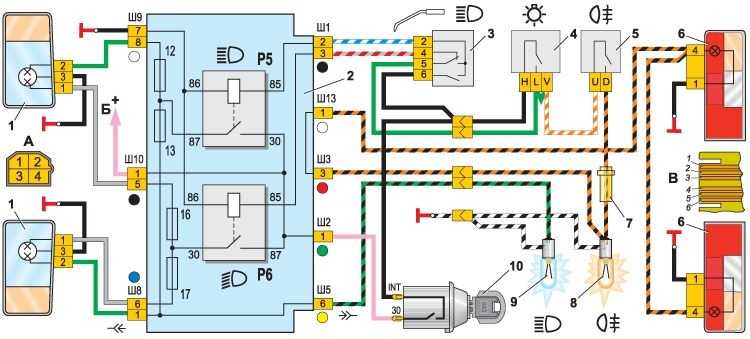
Электрооборудование ВАЗ-21074
1- блок-фары;
2- боковые указатели поворота;
3- аккумуляторная батарея;
4- реле включения стартера;
5- электропневмоклапан карбюратора;
6- микровыключатель карбюратора;
7- генератор 37.3701;
8- моторедукторы очистителей фар*;
9- датчик включения электродвигателя вентилятора;
10- электродвигатель вентилятора системы охлаждения двигателя;
11- звуковые сигналы;
12- распределитель зажигания;
13- свечи зажигания;
14- стартер ВАЗ-21074;
15- датчик указателя температуры охлаждающей жидкости;
16- лампа освещения моторного отсека;
17- датчик сигнализатора недостаточного давления масла;
18- датчик сигнализатора недостаточного уровня тормозной жидкости;
19- моторедуктор очистителя ветрового стекла;
20- блок управления электропневмоклапаном карбюратора;
21- катушка зажигания;
22- электродвигатель насоса омывателя фар*;
23- электродвигатель насоса омывателя ветрового стекла;
24- монтажный блок;
25- реле очистителя ветрового стекла;
26- реле аварийной сигналаизации и указателей поворота;
27- выключатель стоп-сигнала;
28- выключатель фонарей заднего хода;
29- реле зажигания;
30- выключатель зажигания;
31- трехрычажный переключатель;
32- выключатель аварийной сигнализации;
33- штепсельная розетка для переносной лампы**;
34- переключатель вентилятора отопителя;
35- дополнительный резистор электродвигателя отопителя;
36- лампа сигнализатора включения обогрева заднего стекла;
37- лампа сигнализатора недостаточного уровня тормозной жидкости;
38- блок сигнализаторов;
39- электродвигатель вентилятора отопителя;
40- лампа освещения вещевого ящика;
41- выключатель плафонов на стойках передних дверей;
42- выключатель фонарей сигнализации открытых передних дверей***;
43- фонари сигнализации открытых передних дверей***;
44- соединительная колодка;
45- прикуриватель;
46- часы ВАЗ-21074;
47- выключатель ламп освещения приборов;
48- диод для проверки исправности лампы сигнализатора недостаточного уровня тормозной жидкости;
49- указатель уровня топлива;
50- лампа сигнализатора резерва топлива;
51- спидиметр;
52- лампа сигнализатора включенияуказателей поворота;
53- лампа сигнализатора прикрытия воздушной заслонки карбюратора;
54- лампа сигнализатора зарядка аккумуляторной батареи;
55- выключатель сигнализатора прикрытия воздушной заслонки карбюратора;
56- комбинация приборов;
57- эконометр;
58- выключатели плафона на стойках задних дверей;
59- указатель температуры охлаждающей жидкости;
60- тахометр 21074;
61- лампа сигнализатора включения стояночного тормоза;
62- лампа сигнализатора недостаточного давления масла;
63- лампа сигнализатора включения дальнего света;
64- лампа сигнализатора включения наружнего освещения;
65- вольтметр;
66- выключатель сигнализатора включения стояночного тормоза;
67- выключатель ламп наружнего освещения;
68- выключатель элемента обогрева заднего стекла с лампой подсветки;
69- выключатель фонарей заднего противотуманного света с сигнализатором включения*;
70- предохранитель цепи фонарей противотуманного света;
71- плафон;
72- задние фонари ВАЗ 21074;
73- датчик указателя уровня и резерва топлива;
74- колодки для подключения к элементу обогрева заднего стекла*;
75- фонари освещения номерного знака.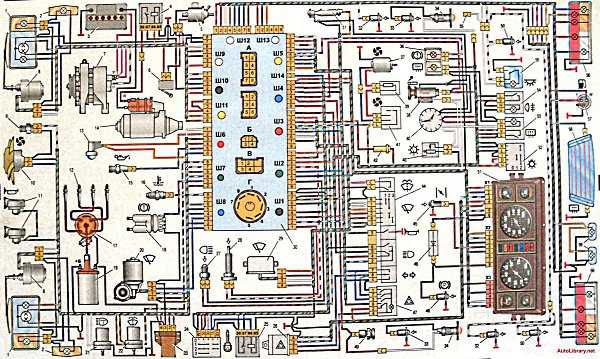
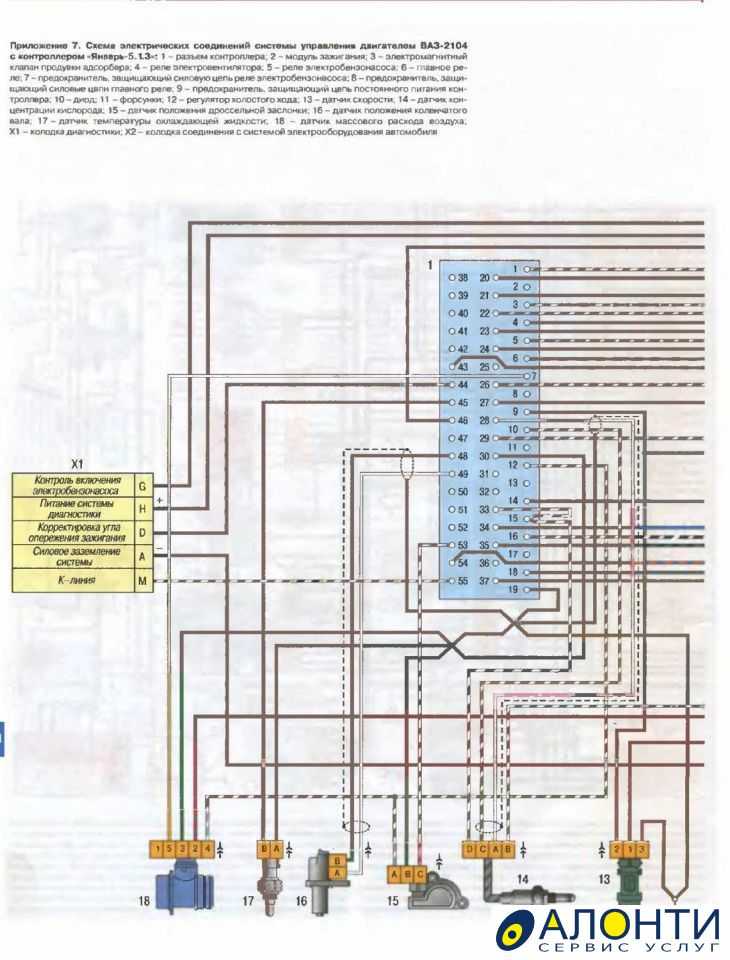
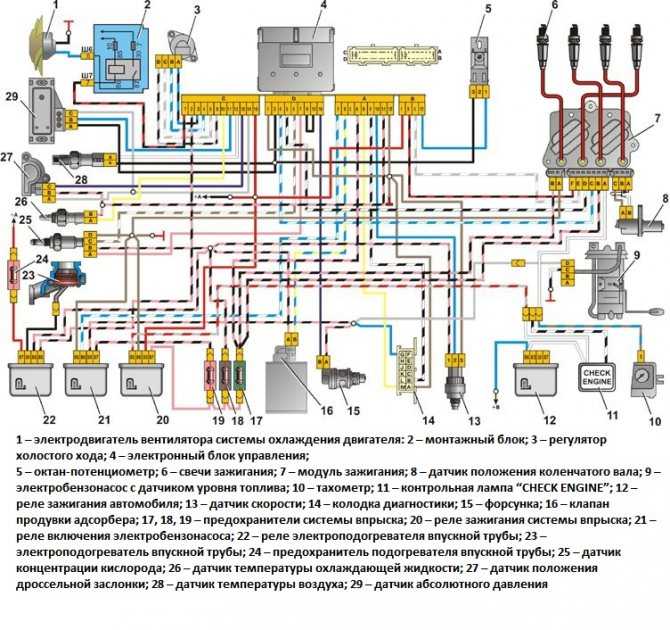
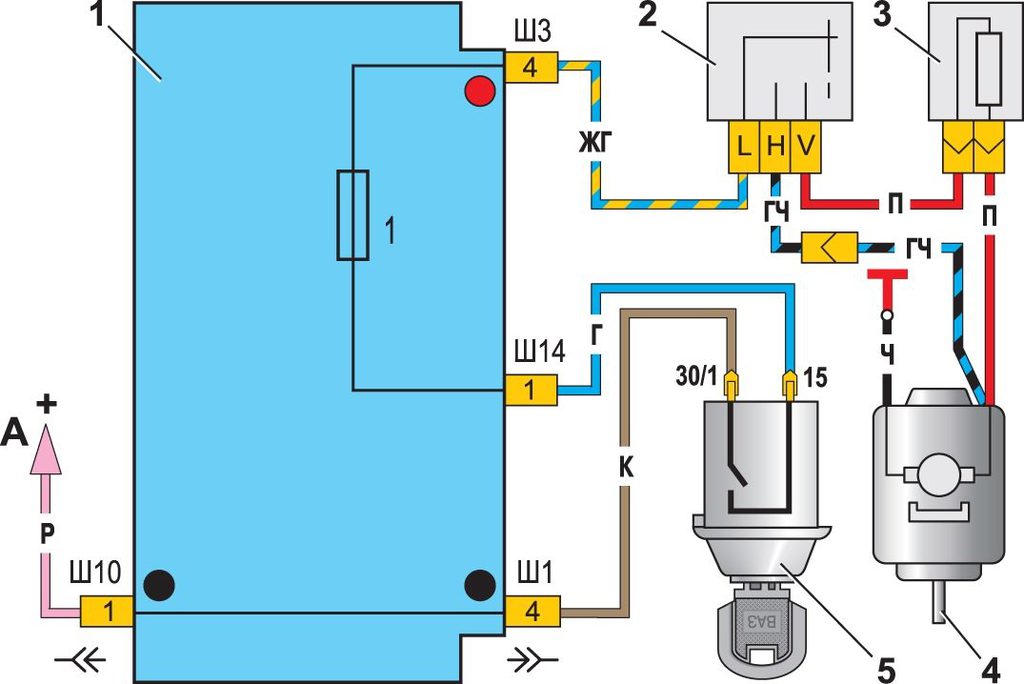
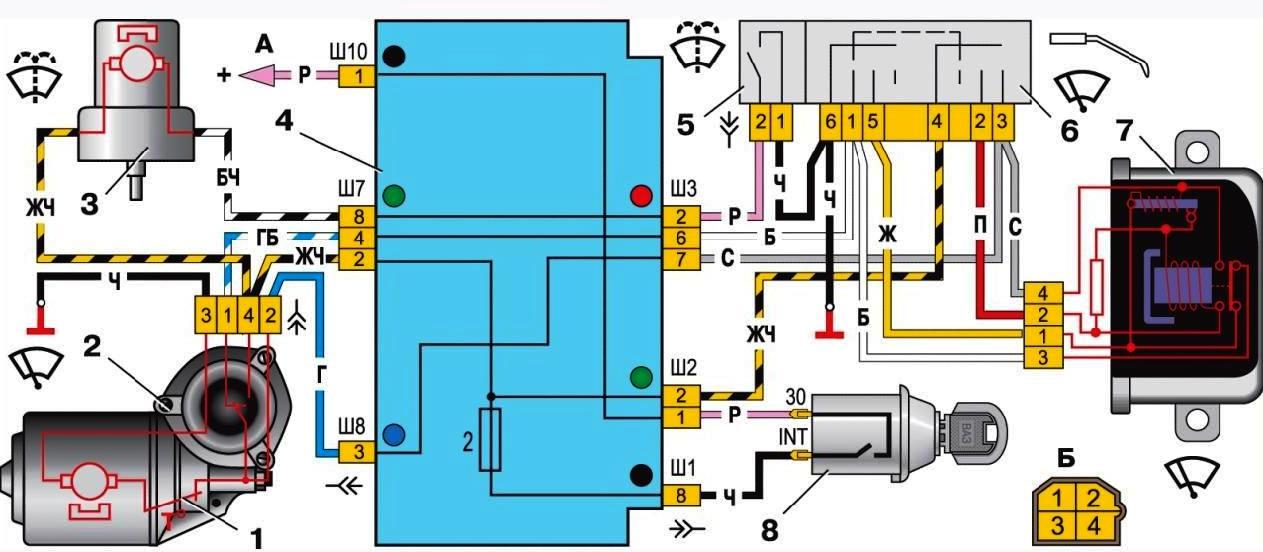
Схема системы управления двигателем ВАЗ 21074
Электро-схема электрических соединений ЭСУД ВАЗ 21074 — элементы схемы.
1 — разъем контроллера;
2 — датчик массового расхода воздуха;
3 — датчик температуры охлаждающей жидкости;
4 — датчик положения коленчатого вала;
5 — датчик положения дроссельной заслонки;
6 — датчик концентрации кислорода;
7 — датчик скорости;
8 — модуль зажигания;
9 — электромагнитный клапан продувки адсорбера;
10 — реле электро-вентилятора;
11 — реле электро-бензонасоса;
12 — главное реле;
13 — предохранитель на силовую цепь реле электробензонасоса:
14 — предохранитель на силовые цепи главного реле;
15 — плавкая вставка;
16-предохраитель, защищающий цепь постоянного питания контроллера;
17 — диод; 18 — регулятор холостого хода;
19 — форсунки;
Х1 — колодка диагностики;
Х2 — колодка соединения с системой электрооборудования автомобиля.
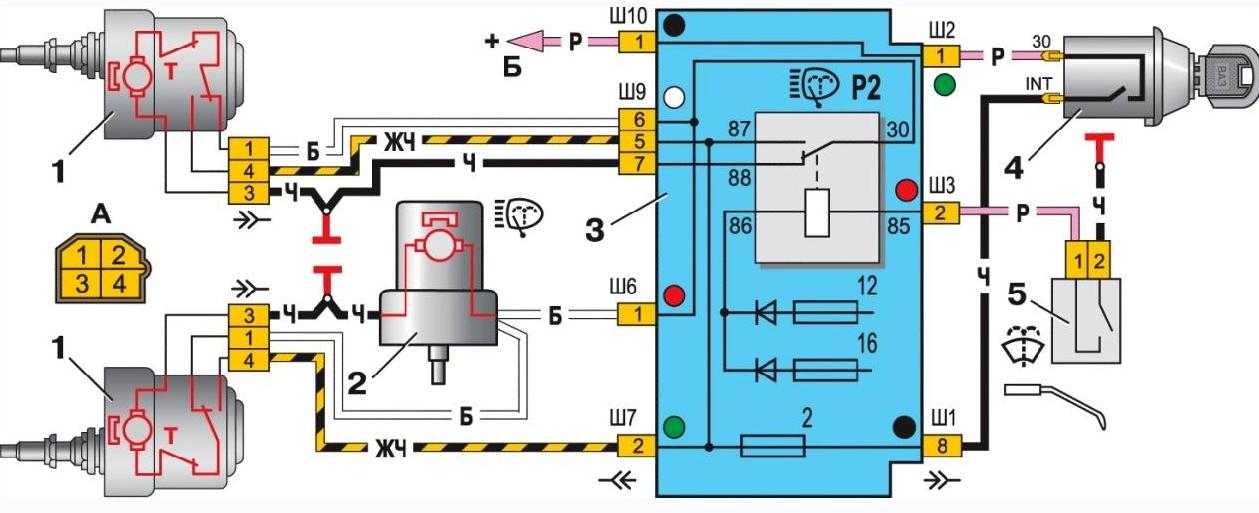
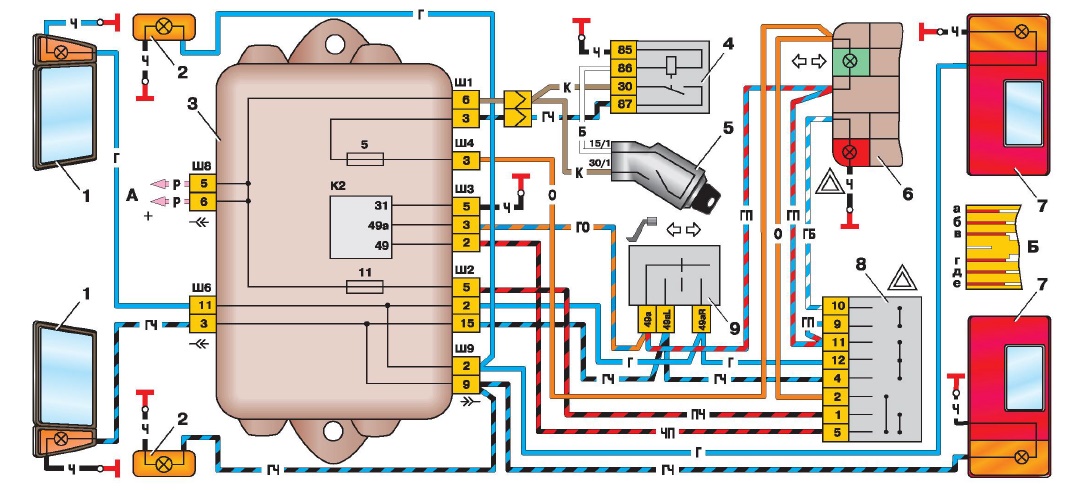
Блок предохранителей Ваз-21074 инжектор
1-Реле обогрева заднего стекла
2-Реле очистителей и омывателей Фар(если есть)
3-реле или перемычка сигналов (если нет внешнего реле)
4-реле или перемычка вентилятора охлаждения
5-реле дальнего света
6-реле ближнего света
F1-F17-Предохранители
1 (8А) Задние фонари (свет заднего хода).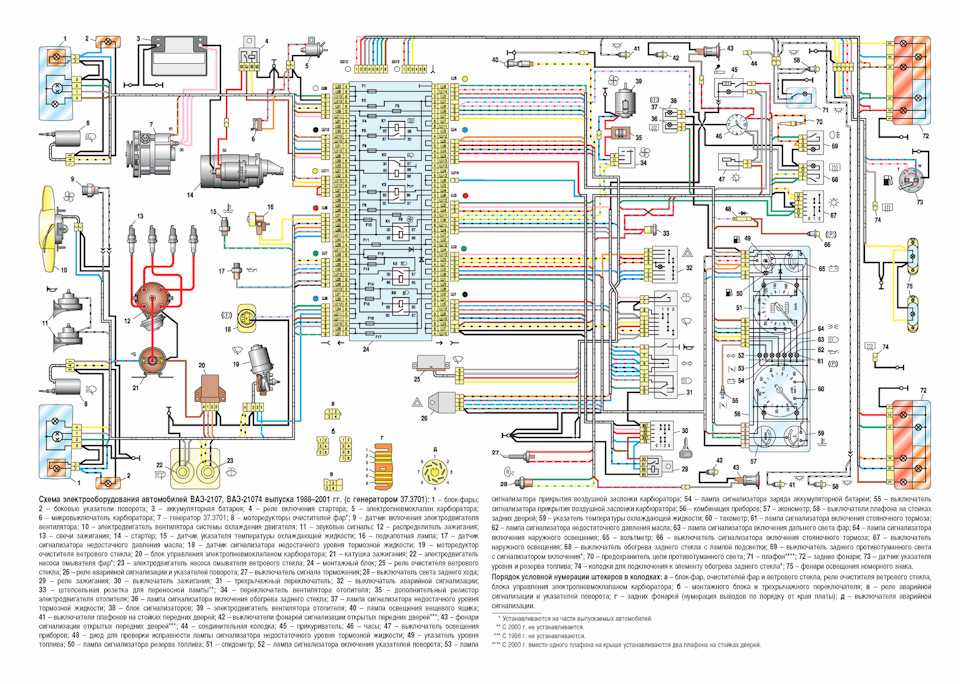 Электродвигатель отопителя. Контрольная лампа и реле обогрева заднего стекла.
Электродвигатель отопителя. Контрольная лампа и реле обогрева заднего стекла.
2 (8А) Электродвигатели стеклоочистителя и омывателя ветрового стекла. Электродвигатели очистителей и омывателя фар. Реле очистки ветрового стекла. Реле очистителей и
омывателя фар (контакты).
3 (8А) Резервный.
4 (8А) Резервный.
5 (16А) Элемент обогрева заднего стекла и реле включения обогрева (контакты)
7 (16А) Звуковые сигналы и реле включения звуковых сигналов. Электродвигатель вентилятора системы охлаждения двигателя и реле включения электродвигателя.
8 (8А) Указатели поворота в режиме аварийной сигнализации. Выключатель и реле-прерыватель указателей поворота и аварийной сигнализации в режиме аварийной сигнализации.
9 (8А) Регулятор напряжения генератора.
10 (8А) Указатели поворота в режиме указания поворота и соответствующая контрольная лампа. Реле включения электродвигателя вентилятора (обмотка).
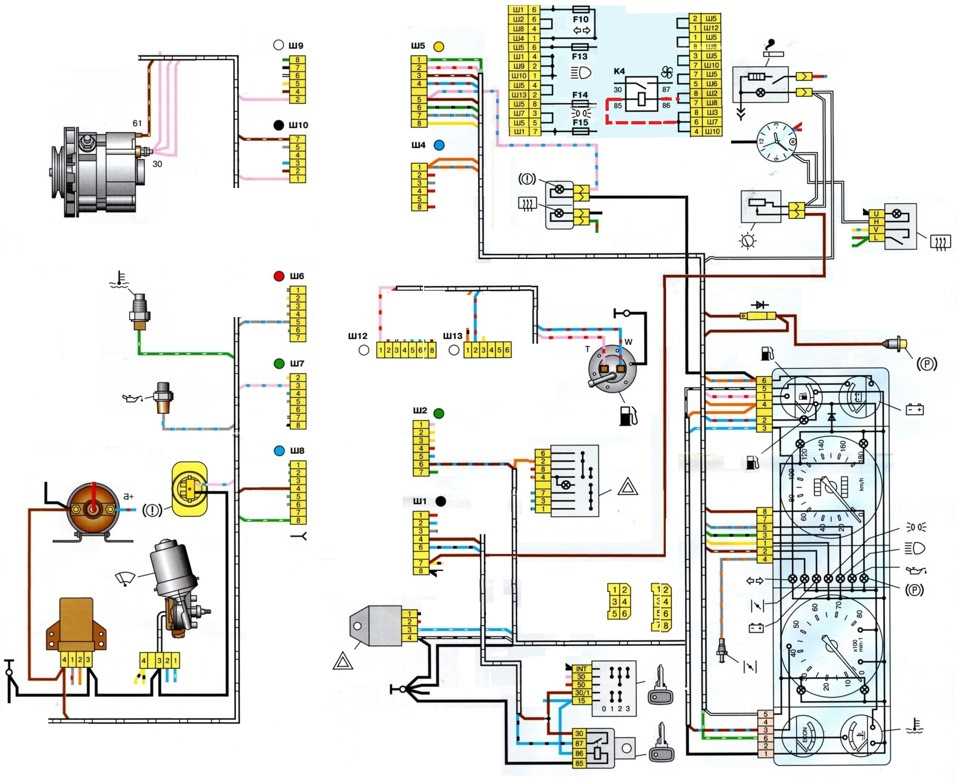 Контрольные приборы. Контрольная лампа заряда аккумуляторной батареи. Контрольные лампы резерва топлива, давления масла, стояночного тормоза и уровня тормозной жидкости. Реле-прерыватель контрольной лампы стояночного тормоза. Система управления пневмоклапаном карбюратора
Контрольные приборы. Контрольная лампа заряда аккумуляторной батареи. Контрольные лампы резерва топлива, давления масла, стояночного тормоза и уровня тормозной жидкости. Реле-прерыватель контрольной лампы стояночного тормоза. Система управления пневмоклапаном карбюратора12 (8А) Правая фара. Обмотка реле включения очистителей фар (при включенном дальнем свете)
13 (8А) Левая фара. Контрольная лампа включения дальнего света фар.
14 (8А) Левая фара (габаритный свет). Правый задний фонарь (габаритный свет). Фонари освещения номерного знака. Подкапотная лампа. Контрольная лампа включения габаритного света.
15 (8А) Правая фара (габаритный свет). Левый задний фонарь (габаритный свет). Лампа освещения прикуривателя. Лампы освещения приборов. Лампа освещения вещевого ящика
16 (8А) Правая фара (ближний свет). Обмотка реле включения очистителей фар.
17 (8А) Левая фара (ближний свет).
S-Pb.
 Chipdiagnost.Диагностика двигателя, чип-тюнинг автомобилей и зап.части для иномарок в Санкт-Петербурге S-Pb.Chipdiagnost.Диагностика двигателя, чип-тюнинг автомобилей и зап.части для иномарок в Санкт-Петербурге
Chipdiagnost.Диагностика двигателя, чип-тюнинг автомобилей и зап.части для иномарок в Санкт-Петербурге S-Pb.Chipdiagnost.Диагностика двигателя, чип-тюнинг автомобилей и зап.части для иномарок в Санкт-Петербурге
|
CHIPDIAGNOST диагностика и чип-тюнинг автомобилей в Санкт-Петербурге |
|
Добро пожаловать!
Электрические схемы ВАЗ.
Схема электрических соединений жгута проводов панели приборов в сборе LADA 21054
|
|
 Диагностика двигателя и чип-тюнинг автомобилей в Санкт-Петербурге Диагностика двигателя и чип-тюнинг автомобилей в Санкт-Петербурге |
Протеаза SPRTN и SUMOylation координируют репарацию ДНК-белковых перекрестных связей для предотвращения нестабильности генома Формальдегид: интеграция дозиметрии, цитотоксичности и геномики для понимания дозозависимых переходов для эндогенного соединения. Токсикол. науч. 2010; 118:716–731. [PubMed] [Google Scholar]
Апарисио Т., Баер Р., Готтесман М., Готье Дж. MRN, CtIP и BRCA1 опосредуют репарацию аддуктов топоизомеразы II-ДНК. J. Cell Biol. 2016;212:399–408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ашур М.Э., Аттея Р., Эль-Хамиси С.Ф. Восстановление хромосомных разрывов, опосредованное топоизомеразой: новый игрок во многих играх. Нац. Преподобный Рак. 2015;15:137–151. [PubMed] [Google Scholar]
Borgermann N., Ackermann L., Schwertman P., Hendriks I.A., Thijssen K., Liu J.C., Lans H., Nielsen ML, Mailand N. . EMBO J.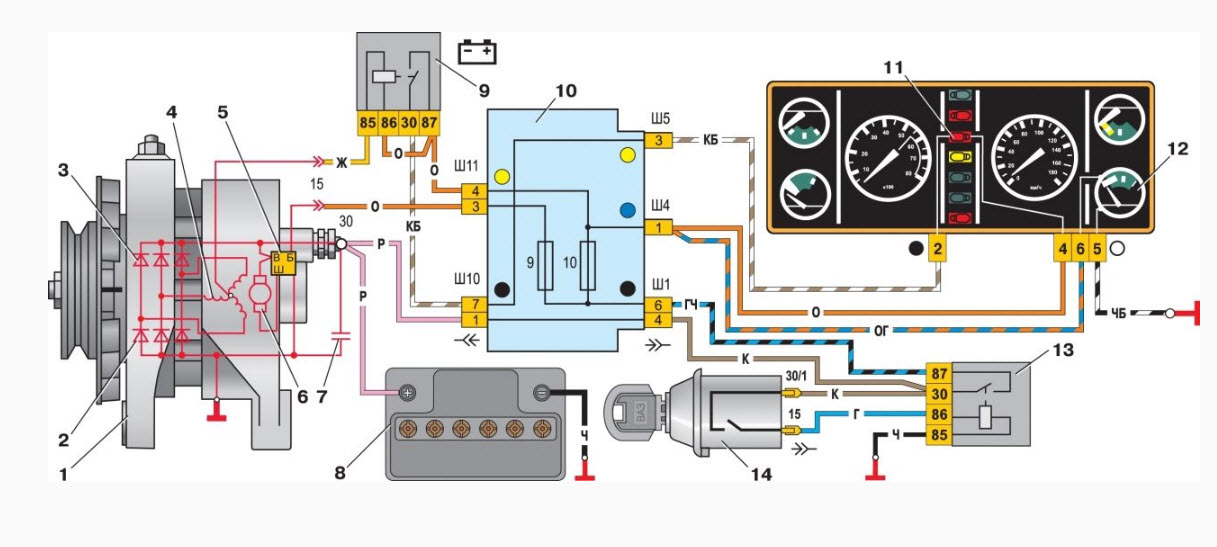 2019; 38:e101496. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2019; 38:e101496. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Branzei D., Sollier J., Liberi G., Zhao X., Maeda D., Seki M., Enomoto T., Ohta K., Foiani M. Ubc9- и mms21-опосредованное сумоилирование противодействует рекомбиногенным событиям при поврежденной репликации вилки. Клетка. 2006; 127: 509–522. [PubMed] [Google Scholar]
Чеккальди Р., Саранджи П., Д’Андреа А.Д. Путь анемии Фанкони: новые игроки и новые функции. Нац. Преподобный Мол. Клеточная биол. 2016;17:337–349. [PubMed] [Google Scholar]
Centore RC, Yazinski S.A., Tse A., Zou L. Spartan/C1orf124, читатель убиквитинирования PCNA и регулятор реакции на повреждение ДНК, вызванной УФ-излучением. Мол. Клетка. 2012;46:625–635. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клэр Г. Тест на хромосомные аберрации млекопитающих in vitro. Методы Мол. биол. 2012; 817: 69–91. [PubMed] [Google Scholar]
Кортес Д. Предотвращение коллапса вилки репликации для поддержания целостности генома.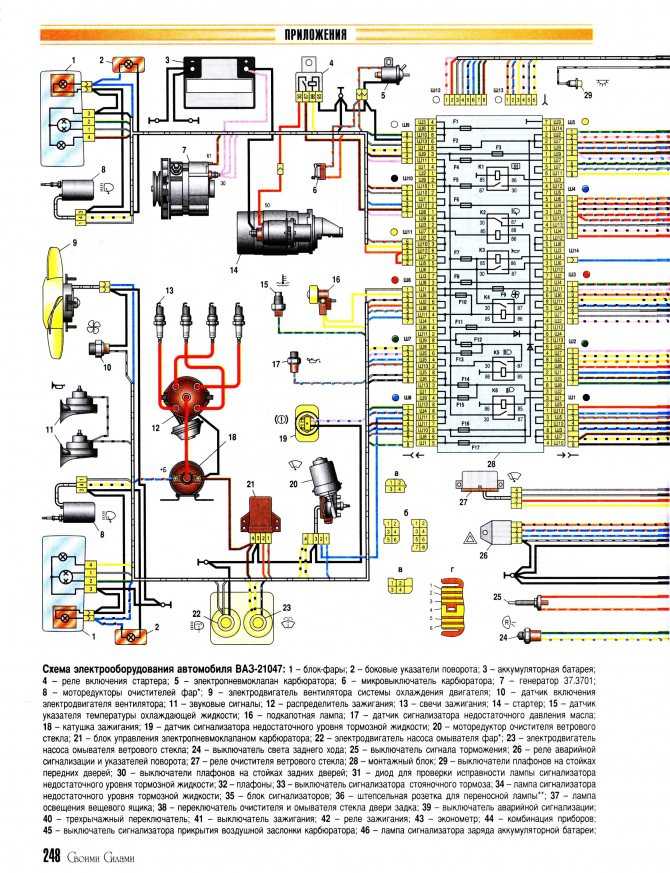 Ремонт ДНК (Амстердам) 2015; 32: 149–157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ремонт ДНК (Амстердам) 2015; 32: 149–157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Davis E.J., Lachaud C., Appleton P., Macartney T.J., Näthke I., Rouse J. DVC1 (C1orf124) рекрутирует белковую сегрегазу p97 в места повреждения ДНК. Нац. Структура Мол. биол. 2012;19:1093–1100. [PubMed] [Академия Google]
де Грааф Б., Клор А., Маккалоу А.К. Клеточные пути репарации ДНК и толерантности к повреждению формальдегид-индуцированных ДНК-белковых поперечных связей. Восстановление ДНК (Амстердам) 2009; 8: 1207–1214. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Десаи С.Д., Лю Л.Ф., Васкес-Абад Д., Д’Арпа П. Убиквитин-зависимая деструкция топоизомеразы I стимулируется противоопухолевым препаратом камптотецином. Дж. Биол. хим. 1997; 272:24159–24164. [PubMed] [Google Scholar]
Desai S.D., Zhang H., Rodriguez-Bauman A., Yang J.-M., Wu X., Gounder MK, Rubin E.H., Liu LF. Транскрипционно-зависимая деградация топоизомеразы I-ДНК ковалентные комплексы. Мол. Клетка. биол. 2003; 23:2341–2350. [Бесплатная статья PMC] [PubMed] [Google Scholar]
биол. 2003; 23:2341–2350. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Duxin J.P., Dewar J.M., Yardimci H., Walter J.C. Восстановление поперечной связи ДНК-белок с помощью протеолиза, связанного с репликацией. Клетка. 2014; 159:346–357. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Филден Дж., Руджиано А., Попович М., Рамадан К. Репарация протеолиза перекрестных связей белка ДНК: от дрожжей до преждевременного старения и рака у людей. Ремонт ДНК (Амст.) 2018; 71: 198–204. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Филден Дж., Уайзман К., Торресилья И., Ли С., Хьюм С., Чианг С.С., Руджиано А., Нараян Сингх А., Фрейре Р., Хассание С. и др. TEX264 координаты p97- и SPRTN-опосредованное разрешение аддуктов топоизомеразы 1-ДНК. Нац. коммун. 2020;11:1274. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Flynn J.M., Neher S.B., Kim Y.I., Sauer R.T., Baker T.A. Протеомное открытие клеточных субстратов протеазы ClpXP выявило пять классов сигналов распознавания ClpX. Мол. Клетка. 2003; 11: 671–683. [PubMed] [Google Scholar]
Мол. Клетка. 2003; 11: 671–683. [PubMed] [Google Scholar]
Ghosal G., Leung J.W.C., Nair BC, Fong K.W., Chen J. Белок C1orf124, связывающий ядерный антиген пролиферирующих клеток (PCNA), является регулятором синтеза трансфузий. Дж. Биол. хим. 2012; 287:34225–34233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гомес-Эррерос Ф., Шуурс-Хоймакерс Дж.Х.М., МакКормак М., Грелли М.Т., Рултен С., Ромеро-Гранадос Р., Кунихан Т.Дж., Чайла Э., Конрой Дж., Эннис С. и др. TDP2 защищает транскрипцию от абортивной активности топоизомеразы и необходим для нормальной нервной функции. Нац. Жене. 2014; 46: 516–521. [PubMed] [Google Scholar]
Guirouilh-Barbat J., Lambert S., Bertrand P., Lopez B.S. Действительно ли гомологичная рекомбинация является безошибочным процессом? Передний. Жене. 2014;5:175. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гальдер С., Торресилья И., Буркхальтер М.Д., Попович М., Филден Дж., Ваз Б., Олер Дж., Пилгер Д., Лессел Д., Уайзман К. и др. Петля перекрестной активации протеазы SPRTN и киназы 1 контрольной точки защищает репликацию ДНК. Нац. коммун. 2019;10:3142. [PMC бесплатная статья] [PubMed] [Google Scholar]
и др. Петля перекрестной активации протеазы SPRTN и киназы 1 контрольной точки защищает репликацию ДНК. Нац. коммун. 2019;10:3142. [PMC бесплатная статья] [PubMed] [Google Scholar]
Harper JV Синхронизация клеточных популяций в фазах G 1 /S и G 2 /M клеточного цикла. Методы Мол. биол. 2005; 296:157–166. [PubMed] [Академия Google]
Henderson C.J., Wolf C.R. Иммунодетекция белков методом вестерн-блоттинга. Методы Мол. биол. 1992; 80: 221–233. [PubMed] [Google Scholar]
Хоа Н.Н., Симидзу Т., Чжоу З.В., Ван З.К., Дешпанде Р.А., Полл Т.Т., Актер С., Цуда М., Фурута Р., Цуцуи К. и др. Mre11 необходим для удаления летальных комплексов ковалентного расщепления топоизомеразой 2. Мол. Клетка. 2016;64:580–592. [PubMed] [Google Scholar]
Идэ Х., Накано Т., Салем А.М.Х., Шоулками М.И. ДНК-белковые перекрестные связи: огромные проблемы для поддержания целостности генома. Ремонт ДНК (Амст.) 2018; 71:190–197. [PubMed] [Google Scholar]
Interthal H. , Champoux J.J. Влияние размера ДНК и белка на расщепление субстрата тирозил-ДНК-фосфодиэстеразой человека 1. Biochem. Дж. 2011; 436: 559–566. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Champoux J.J. Влияние размера ДНК и белка на расщепление субстрата тирозил-ДНК-фосфодиэстеразой человека 1. Biochem. Дж. 2011; 436: 559–566. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Juhasz S., Balogh D., Hajdu I., Burkovics P., Villamil M.A., Zhuang Z., Haracska L. Характеристика человека Spartan/C1orf124, убиквитин- Взаимодействующий с PCNA регулятор толерантности к повреждениям ДНК. Нуклеиновые Кислоты Res. 2012;40:10795–10808. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кианица К., Майзелс Н. Быстрый и чувствительный анализ ДНК-белковых ковалентных комплексов в живых клетках. Нуклеиновые Кислоты Res. 2013;41:e104. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kühbacher U., Duxin J.P. Как исправить перекрестные связи ДНК-белок. Ремонт ДНК (Амст.) 2020; 94: 102924. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кумари А., Лим Ю.С., Ньюэлл А.Х., Олсон С.Б., Маккалоу А.К. Вызванная формальдегидом нестабильность генома подавляется XPF-зависимым путем. Восстановление ДНК (Амстердам) 2012; 11: 236–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Восстановление ДНК (Амстердам) 2012; 11: 236–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ларсен Н.Б., Гао А.О., Спаркс Дж.Л., Галлина И., Ву Р.А., Манн М., Рэшле М., Уолтер Дж.К., Даксин Дж.П. Репарация ДНК-белковых перекрестных связей, связанная с репликацией, с помощью SPRTN и протеасомы в экстрактах яиц Xenopus . Мол. Клетка. 2019;73:574–588.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лессел Д., Ваз Б., Гальдер С., Локхарт П.Дж., Маринович-Терзич И., Лопес-Москеда Дж., Филипп М., Сим Дж.Ч., Смит К.Р. , Олер Дж. и др. Мутации в SPRTN вызывают раннее начало гепатоцеллюлярной карциномы, нестабильность генома и прогероидные признаки. Нац. Жене. 2014;46:1239–1244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лин С.П., Бан Ю., Лю Ю.Л., Десаи С.Д., Лю Л.Ф. Убиквитин-протеасомный путь восстановления ковалентных комплексов топоизомераза I-ДНК. Дж. Биол. хим. 2008; 283:21074–21083. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ссылка AJ, LaBaer J.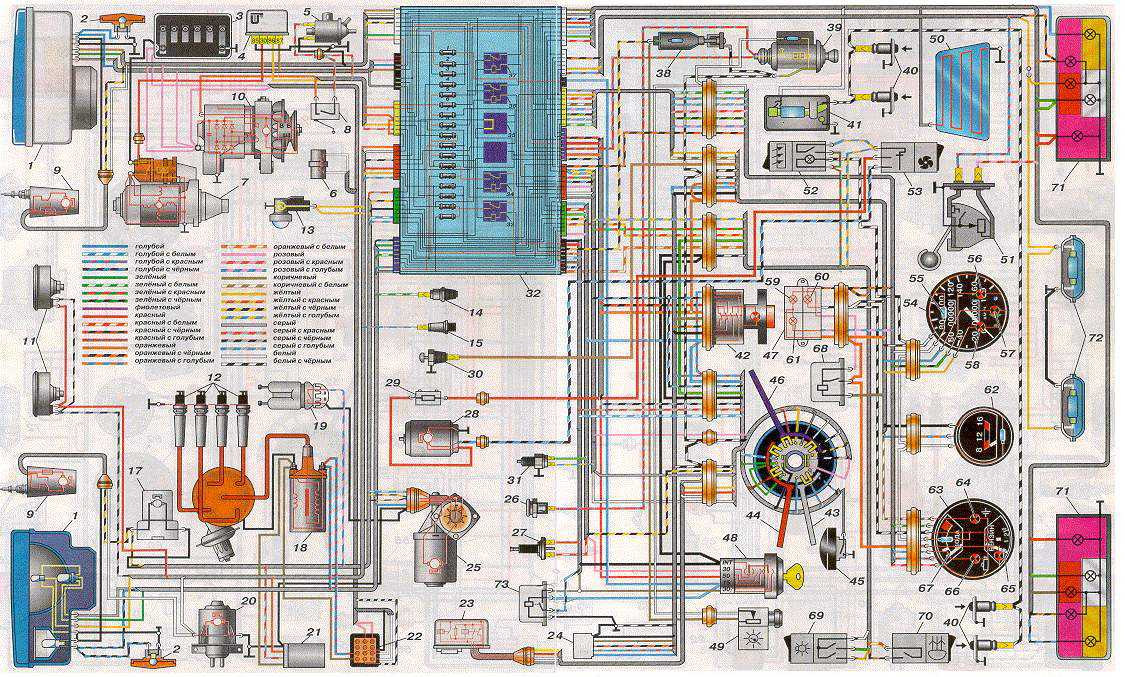 Осаждение белков трихлоруксусной кислотой (TCA). Харб Колд Спринг. протокол 2011; 2011: 993–994. [PubMed] [Google Scholar]
Осаждение белков трихлоруксусной кислотой (TCA). Харб Колд Спринг. протокол 2011; 2011: 993–994. [PubMed] [Google Scholar]
Liu P., Carvalho CMB, Hastings PJ, Lupski JR Механизмы повторяющихся и сложных геномных перестроек человека. Курс. мнение Жене. Дев. 2012;22:211–220. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Lopez-Mosqueda J., Maddi K., Prgomet S., Kalayil S., Marinovic-Terzic I., Terzic J., Dikic I. SPRTN представляет собой ДНК-связывающую металлопротеазу млекопитающих, которая расщепляет ДНК-белковые поперечные связи. электронная жизнь. 2016; 5:1–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Machida Y., Kim M.S., Machida YJ Spartan/C1orf124 важен для предотвращения мутагенеза, вызванного УФ-излучением. Клеточный цикл. 2012;11:3395–3402. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мао Ю., Сунь М., Десаи С.Д., Лю Л.Ф. Конъюгация SUMO-1 с топоизомеразой I: возможный ответ на восстановление ДНК, опосредованное топоизомеразой. проц. Натл. акад. науч. США. 2000;97:4046–4051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2000;97:4046–4051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mao Y., Desai S.D., Ting CY, Hwang J., Liu LF. Опосредованная протеасомами деградация расщепляемых комплексов топоизомеразой II 26S. Дж. Биол. хим. 2001; 276:40652–40658. [PubMed] [Google Scholar]
Маски Р.С., Ким М.С., Бейкер Д.Дж., Чайлдс Б., Малуриану Л.А., Джеганатан К.Б., Мачида Ю., ван Деурсен Дж.М., Мачида Ю.Дж. Дефицит спартана вызывает геномную нестабильность и прогероидные фенотипы. Нац. коммун. 2014;5:5744. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Маскей Р.С., Флаттен К.С., Зибен С.Дж., Петерсон К.Л., Бейкер Д.Дж., Нам Х.Дж., Ким М.С., Смырк Т.С., Кодзима Ю., Мачида Ю. и др. Дефицит Spartan вызывает накопление комплексов расщепления топоизомеразой 1 и онкогенез. Нуклеиновые Кислоты Res. 2017; 45:4564–4576. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мессик Т.Е., Гринберг Р.А. Убиквитиновый ландшафт при двухцепочечных разрывах ДНК.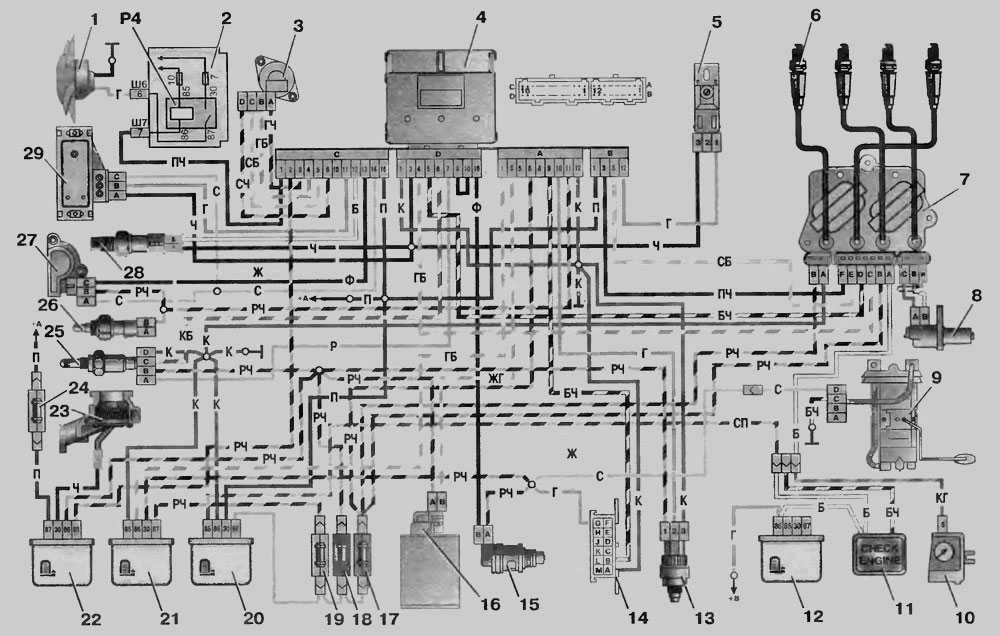 J. Cell Biol. 2009; 187: 319–326. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J. Cell Biol. 2009; 187: 319–326. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mórocz M., Zsigmond E., Tóth R., Enyedi M.Z., Pintér L., Haracska L. ДНК-зависимая протеазная активность человеческого спартанца облегчает репликацию ДНК-белка ДНК, содержащая перекрестные связи. Нуклеиновые Кислоты Res. 2017;45:3172–3188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мосбех А., Гиббс-Сеймур И., Кагиас К., Торслунд Т., Бели П., Повлсен Л., Нильсен С.В., Смедегаард С., Седжвик Г., Лукас С. и др. DVC1 (C1orf124) представляет собой адаптер p97, нацеленный на повреждение ДНК, который способствует убиквитин-зависимым ответам на блоки репликации. Нац. Структура Мол. биол. 2012;19:1084–1092. [PubMed] [Google Scholar]
Накано Т., Морисита С., Катафучи А., Мацубара М., Хорикава Ю., Терато Х., Салем А.М.Х., Изуми С., Пак С.П., Макино К., Иде Х. Системы эксцизионной репарации нуклеотидов и системы гомологичной рекомбинации по-разному участвуют в репарации поперечных связей ДНК-белок.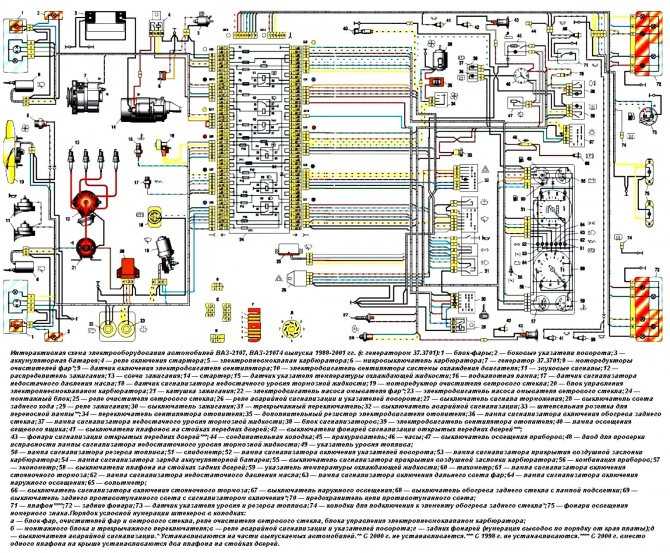 Мол. Клетка. 2007; 28: 147–158. [PubMed] [Академия Google]
Мол. Клетка. 2007; 28: 147–158. [PubMed] [Академия Google]
Накано Т., Катафучи А., Мацубара М., Терато Х., Цубои Т., Масуда Т., Тацумото Т., Пак С.П., Макино К., Крото Д.Л. и др. Гомологическая рекомбинация, а не эксцизионная репарация нуклеотидов, играет ключевую роль в толерантности к перекрестным связям ДНК-белок в клетках млекопитающих. Дж. Биол. хим. 2009; 284:27065–27076. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Наказато А., Кадзита К., Оока М., Акагава Р., Абэ Т., Такеда С., Бранзей Д., Хирота К. СПАРТАНЦ способствует генетической диверсификации локус вариабельного гена иммуноглобулина в птичьих клетках DT40. Ремонт ДНК (Амст.) 2018; 68: 50–57. [PubMed] [Академия Google]
Пашев И.Г., Димитров С.И., Ангелов Д. Сшивание белков с нуклеиновыми кислотами ультрафиолетовым лазерным облучением. Тенденции биохим. науч. 1991; 16: 323–326. [PubMed] [Google Scholar]
Pommier Y., Marchand C. Межфазные ингибиторы: нацеливание на макромолекулярные комплексы. Нац. Преподобный Друг Дисков. 2011;11:25–36. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Нац. Преподобный Друг Дисков. 2011;11:25–36. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Руджиано А., Рамадан К. Протеазы сшивания ДНК и белка в стабильности генома. коммун. биол. 2021;4:11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Руджиано А., Рамадан К. Троица регуляции протеазы SPRTN. Тенденции биохим. науч. 2021; 46: 2–4. [PubMed] [Google Scholar]
Schwertman P., Bekker-Jensen S., Mailand N. Регуляция восстановления двухцепочечных разрывов ДНК с помощью убиквитина и убиквитин-подобных модификаторов. Нац. Преподобный Мол. Клеточная биол. 2016; 17: 379–394. [PubMed] [Google Scholar]
Шетлар М.Д., Кристенсен Дж., Хом К. Фотохимическое присоединение аминокислот и пептидов к ДНК. Фотохим. Фотобиол. 1984; 39: 125–133. [PubMed] [Академия Google]
Smeenk G., Mailand N. Авторы, читатели и ластики убиквитилирования гистонов при репарации двухцепочечных разрывов ДНК. Передний. Жене. 2016;7:122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Сорде О. , Ларошель С., Николас Э., Стивенс Э.В., Чжан С., Шокат К.М., Фишер Р.П., Поммье Ю. Гиперфосфорилирование РНК-полимеразы II в ответ на комплексы расщепления топоизомеразой I и ее связь с транскрипционно- и BRCA1-зависимой деградацией топоизомеразы I. J. Mol. биол. 2008; 381: 540–549.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ларошель С., Николас Э., Стивенс Э.В., Чжан С., Шокат К.М., Фишер Р.П., Поммье Ю. Гиперфосфорилирование РНК-полимеразы II в ответ на комплексы расщепления топоизомеразой I и ее связь с транскрипционно- и BRCA1-зависимой деградацией топоизомеразы I. J. Mol. биол. 2008; 381: 540–549.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Спаркс Дж. Л., Чистол Г., Гао А. О., Рэшле М., Ларсен Н. Б., Манн М., Даксин Дж. П., Уолтер Дж. К. Хеликаза CMG обходит ДНК-белковые поперечные связи для облегчения их ремонта. Клетка. 2019;176:167–181.e21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Stingele J., Jentsch S. Репарация перекрестных связей ДНК-белок. Нац. Преподобный Мол. Клеточная биол. 2015;16:455–460. [PubMed] [Google Scholar]
Stingele J., Schwarz M.S., Bloemeke N., Wolf PG, Jentsch S. ДНК-зависимая протеаза, участвующая в репарации ДНК-белковых поперечных связей. Клетка. 2014; 158:327–338. [PubMed] [Академия Google]
Stingele J., Habermann B., Jentsch S. Репарация ДНК-белковых перекрестных связей: протеазы как ферменты репарации ДНК. Тенденции биохим. науч. 2015;40:67–71. [PubMed] [Google Scholar]
Репарация ДНК-белковых перекрестных связей: протеазы как ферменты репарации ДНК. Тенденции биохим. науч. 2015;40:67–71. [PubMed] [Google Scholar]
Stingele J., Bellelli R., Alte F., Hewitt G., Sarek G., Maslen S.L., Tsutakawa S.E., Borg A., Kjær S., Tainer J.A., et al. Механизм и регуляция репарации ДНК-белковых поперечных связей ДНК-зависимой металлопротеазой SPRTN. Мол. Клетка. 2016; 64: 688–703. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Sun Y., Miller Jenkins LM, Su YP, Nitiss KC, Nitiss JL, Pommier Y. Консервативный путь SUMO восстанавливает поперечные связи топоизомеразы ДНК-белок, задействуя убиквитин- опосредованная протеасомная деградация. науч. Доп. 2020;6:eaba6290. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ваз Б., Попович М., Ньюман Дж. А., Филден Дж., Эйткенхед Х., Гальдер С., Сингх А. Н., Вендрелл И., Фишер Р., Торресилья И. и др. Металлопротеаза SPRTN/DVC1 управляет репарацией ДНК-белковых перекрестных связей, связанной с репликацией. Мол. Клетка. 2016; 64: 704–719. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол. Клетка. 2016; 64: 704–719. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ваз Б., Попович М., Рамадан К. Восстановление протеолиза ДНК-белков. Тенденции биохим. науч. 2017; 42: 483–495. [PubMed] [Академия Google]
Westphal K., Langklotz S., Thomanek N., Narberhaus F. Подход с отловом выявляет новые субстраты и физиологические функции основной протеазы FtsH в Escherichia coli . Дж. Биол. хим. 2012; 287:42962–42971. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Чжао С., Кизер А., Ли Х.Ю., Рейнкинг Х.К., Вейкерт П., Эйтенойер С., Янева Д., Акампора А.С., Гётц М.Дж., Фидерле Р., Stingele J. Переключатель убиквитина контролирует автокаталитическую инактивацию ДНК-белковой репарационной протеазы SPRTN. Нуклеиновые Кислоты Res. 2021;49: 902–915. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Valbella Resort от 20 830 рупий. VAZ/Obervaz Hotel Deals & Reviews
VOA Selva 4, 7077 VAZ/Obervaz, Graubunden, Switzer
+41 81 385 08 08
с
₹ 20 830
4000 2
.
на основании 179 отзывов
Valbella Resort
Пн 6/3
Пт 10/3
| Поставщик | Nightly total |
|---|---|
| KAYAK | ₹ 20,830 |
| Orbitz | ₹ 23,249 |
| Booking.com | ₹ 24,275 |
7 more Valbella Resort deals from ₹ 20,830
Еще 7 Valbella Resort по цене от 20 830
О курорте Valbella
Этот роскошный отель расположен в горах, в нескольких шагах от горнолыжного курорта Фастач и Ароза Ленцерхайде. Горнолыжный подъемник Вальбелла и Обертор также находятся в 15 минутах ходьбы. Станция гондольного подъемника Lenzerheide/Lai LHB находится в 15 минутах ходьбы.
Photos of Valbella Resort
Latest deals for Valbella Resort
Mon 6/3
Fri 10/3
Show deals with
Free cancellation
Free breakfast
Standard rooms(₹ 35,179 — 37 287 ₹)
Стандартный номер
без конкретной кровати
без конкретной кровати
35 179 ₹ за ночь
35 179 ₹ 35 179 totalHotels.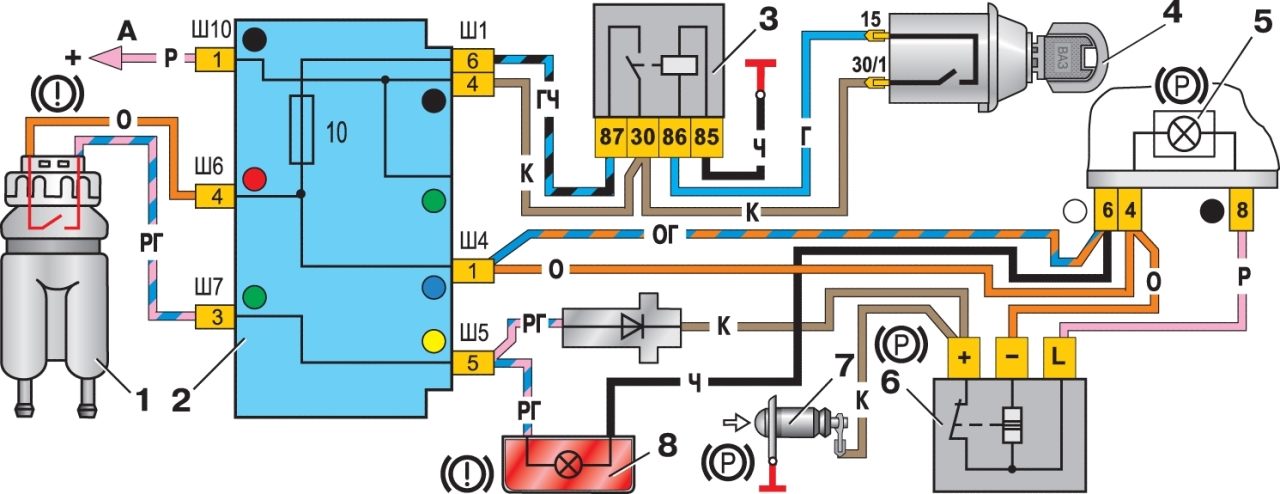 com
com
09 35 кровать3 900 View Deal0002 No Bed Special
₹ 37 287/ночь
₹ 37 287 Totalbooking.com
View Deal
Двойные номера (20 830 — ₹ 45 000)
Double Room
No Bed Speciate
NO
9000 2
9000 2 9000 2 9000 2
9000 2
9000 2 9000 2
9000 2 9000 2 9000 2 9000 2
9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2
NO. /Ночь
₹ 20 830 Totalkayak
View Deal
1 Двойная кровать
1 Двойной кровать
₹ 23 249/Ночь
₹ 23,249 TotorOrbitz
View
NOT SPEPIC
NO0003
₹ 24 275/ночь
₹ 24 275 Totalbooking.com
View Deal
Удобства в Valbella Resort
- . Обслуживание номеров
- Бесплатный Wi-Fi
- Кофеварка/чайник
- Кофемашина
- Услуги парковщика
Отзывы о Valbella Resort
8,7
Очень хорошоНа основании 179 проверенных отзывов гостей Попробуйте удалить фильтр, изменить поиск или очистить все, чтобы просмотреть отзывы.
Расположение
VOA Selva 4, 7077 VAZ/Obervaz, Graubunden
- Ski Lift Valbella0,6 км
- SKM SKM.0288
- Lenzerhorn5,3 км
- Pizzas D’Anarosa24,9 км
Политики
Проверка. :00 | |
|---|---|
Отмена/предоплата | Правила отмены/предоплаты зависят от типа номера и поставщика. |
Часто задаваемые вопросы при бронировании на курорте Valbella Resort
- 9Курортный отель 0002 Valbella расположен по адресу Voa Selva 4, в 2,5 км от центра Ваза/Оберваза. Горнолыжный подъемник Вальбелла является ближайшим ориентиром к курорту Вальбелла.
Время заезда в 16:00 и время выезда в 11:00 в Valbella Resort.
Да, курортный отель Valbella предлагает бесплатный Wi-Fi.
Да, курортный отель Valbella предлагает бесплатную парковку.
Курорт Valbella находится в 81,8 км от города Таль Санкт-Галлен-Альтенрайн.
 Курорт Valbella находится в 96,5 км от Лугано.
Курорт Valbella находится в 96,5 км от Лугано.Да, на территории курортного отеля Valbella есть бассейн.
KAYAK просматривает в Интернете все предложения по размещению в отеле Valbella Resort в Ваз/Оберваз и позволяет вам сравнить их, чтобы найти лучшую цену для вашего пребывания. Многие туристические сайты в разное время предлагают скидки или специальные предложения на номера в курортном отеле Valbella Resort, а KAYAK предоставит вам цены на огромном количестве туристических сайтов. Это означает, что вы всегда можете найти отличное предложение для Valbella Resort.
Ближайшие отели и другие виды жилья
Ближайшие
Посмотреть еще варианты проживания поблизости3-звездочный отель
Posthotel Valbella8.3 Отлично (отзывов: 431)0,14 кмКрытый бассейн, Спа и оздоровительный центр, Ресторан₹ 14
2-звездочный отель
48% дешевлеErlebacherhus8,3 Отлично (295 отзывов)0,83 кмРесторан, Бесплатный Wi-Fi, Бесплатная парковка₹ 7 214+ кмРесторан, Бар/лаунж, Обслуживание номеров₹ 13 444+
3-звездочный отель
7% дешевлеRevier Mountain Lodge Lenzerheide8.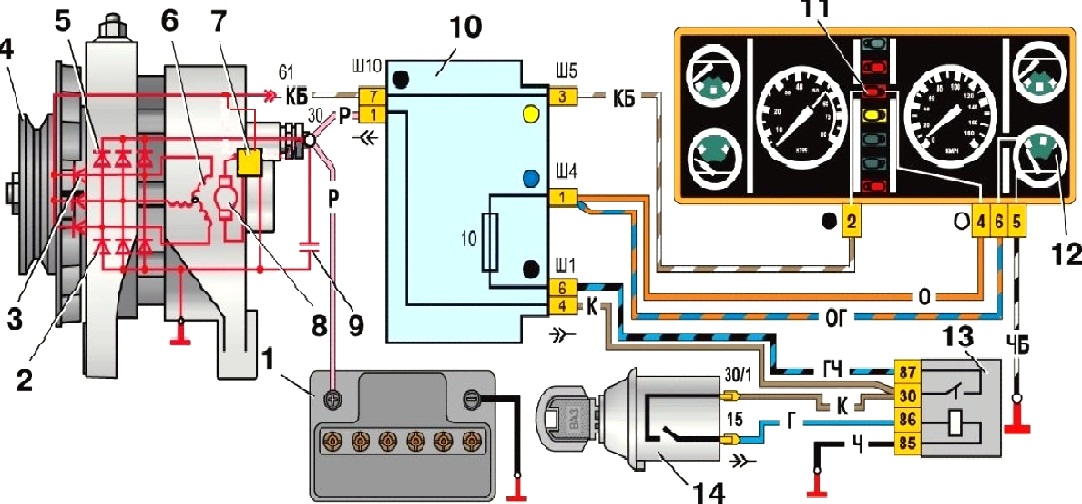


 Курорт Valbella находится в 96,5 км от Лугано.
Курорт Valbella находится в 96,5 км от Лугано.