Кпп ваз 2114 ремонт своими руками видео: как делать правильно ремонт коробки передач
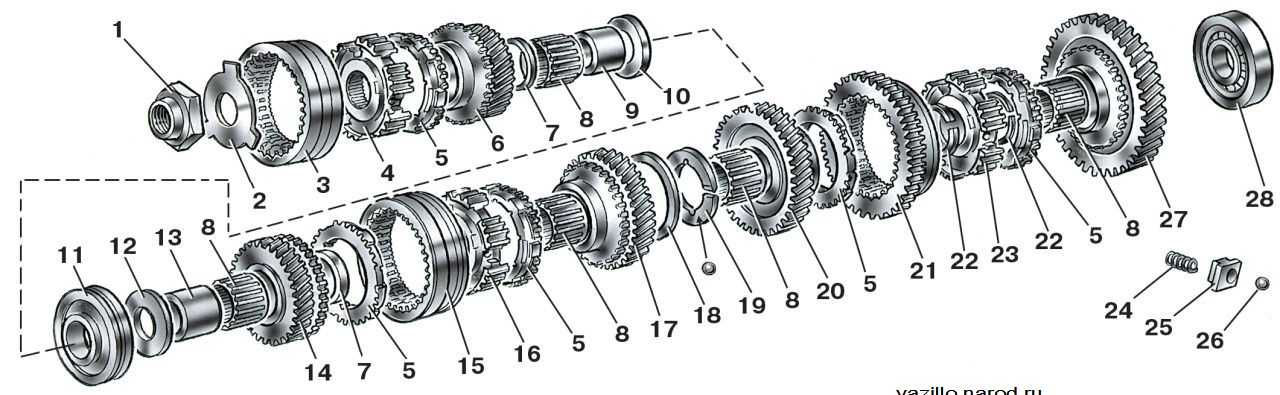
Автолюбителю | Ремонт коробки передач, этапы снятия и установки коробки лада 2115, инструкции по разборке и сборке дифференциала лада 2114, замена шестерней в коробке автомобиля ваз 2113, ваз 2115, ваз 2114. Раздел по ремонту трансмиссии лада 2114, сцепления, привода колес. Ремонт дифференциала лада 2115, вторичного вала и первичного вала лада 2113. Промойте коробку передач лада самара 2, не допуская попадания воды в картер, и установите ее на стенд для разборки. Снимите кронштейн подвески силового агрегата и кронштейн крепления троса выключения сцепления. Коробка передач: 1 – подшипник выключения сцепления; 2 – направляющая втулка; 3 – первичный вал; 4 – роликовый подшипник вторичного вала; 5 – вторичный вал; 6 – стопорное кольцо; 7 – ось сателлитов; 8 – ведущая шестерня привода спидометра; 9 – заглушка транспортная; 10 – сальник привода колеса; 11 – роликовый конический подшипник дифференциала; 12 – шестерня полуоси; 13 – сателлит; 14 – коробка дифференциала; 15 – картер сцепления; 16 – ведомая шестерня главной передачи; 17 – пробка сливного отверстия; 18 – регулировочное кольцо; 19 – ведомая шестерня I передачи вторичного вала; 20 – синхронизатор I и II передачи в сборе; 21 – ведомая шестерня II передачи вторичного вала; 22 – стопорное кольцо; 23 – упорное полукольцо; 24 – ведомая шестерня III передачи вторичного вала; 25 – синхронизатор III и IV передачи в сборе; 26 – ведомая шестерня IV передачи вторичного вала; 27 – игольчатый подшипник шестерен вторичного вала; 28 – шариковый подшипник вторичного вала; 29 – упорная пластина; 30 – ведомая шестерня V передачи вторичного вала; 31 – синхронизатор V передачи в сборе; 32 – гайка; 33 – упорная шайба; 34 – ведущая шестерня V передачи первичного вала; 35 – задняя крышка картера коробки передач; 36 – шариковый подшипник первичного вала; 37 – картер коробки передач; 38 – роликовый подшипник первичного вала; 39 – сапун; 40 – сальник первичного вала Отвернув гайки, снимите заднюю крышку 35 картера коробки передач ваз 2113 и уплотнительную прокладку. Снятие первичного и вторичного валов Выньте одновременно первичный и вторичный валы из роликовых подшипников картера сцепления ваз 2115, а затем снимите дифференциал. Снятие механизма выбора передач Отверните болты крепления механизма выбора передач и снимите его. ПРИМЕЧАНИЕ Детали вторичного вала: 1 – гайка; 2 – упорная пластина; 3 – скользящая муфта синхронизатора V передачи; 4 – ступица скользящей муфты; 5 – блокирующее кольцо синхронизатора; 6 – шестерня V передачи; 7 – дистанционное кольцо игольчатого подшипника; 8 – игольчатый подшипник; 9 – втулка шестерни V передачи; 10 – упорная шайба; 11 – шариковый подшипник; 12 – упорная шайба; 13 – втулка шестерни IV передачи; 14 – шестерня IV передачи; 15 – скользящая муфта синхронизатора III и IV передач; 16 – ступица скользящей муфты; 17 – шестерня III передачи; 18 – стопорное кольцо; 19 – упорные полукольца вторичного вала; 20 – шестерня II передачи; 21 – скользящая муфта синхронизатора I и II передач с зубчатым венцом заднего хода; 22 – стопорное кольцо ступицы синхронизатора; 23 – ступица скользящей муфты синхронизатора I и II передач; 24 – пружина синхронизатора; 25 – сухарь; 26 – фиксатор; 27 – шестерня I передачи; 28 – роликовый подшипник При необходимости разборки вторичного вала ваз 2114, ваз 2115, ваз 2113 зажмите его в тисках с накладками из мягкого материала и универсальным съемником спрессуйте шариковый подшипник с вала. ПРИМЕЧАНИЕ Разберите дифференциал в следующем порядке: Дифференциал ваз 2115 в сборе: 1 – ось сателлитов; 2 – стопорное кольцо; 3 – полуосевые шестерни; 4 – ведущая шестерня привода спидометра; 5 – коробка дифференциала; 6 – сателлит; 7 – ведомая шестерня главной передачи – при необходимости замены ведомой шестерни отверните болты ее крепления и спрессуйте шестерню 7 (рис. Детали механизма выбора передач ваз 2114: 1 – шток выбора передач; 2 – рычаг штока выбора передач; 3 – корпус механизма выбора передач; 4 – трехплечий рычаг выбора передач; 5 – блокировочные скобы; 6 – ось рычага выбора передач; 7 – направляющая ось блокировочных скоб; 8 – вилка включения заднего хода; 9 – фиксатор; 10 – упорная шайба; 11 – пружина При необходимости разберите механизм выбора передач, для чего отверните гайку крепления оси 6 рычага выбора передач ваз 2115 и снимите стопорные кольца с оси вилки заднего хода и с оси 7 блокировочных скоб, снимите вилку 8 заднего хода, рычаг 4 выбора передач в сборе с блокировочной скобой 5, ось 6 рычага и пружину 11 с упорной шайбой 10. Устройство коробки передач Неисправности коробки Снятие и установка коробки передач Разборка коробка передач Проверка коробки Сборка коробка передач Подбор кольца подшипников дифференциала
ВАЗ / 2113, 2114, 2115 / ремонт / трансмиссия / коробка передач / Разборка коробка передач |
Процесс устранения дребезжания рычага КПП на ВАЗ 2114: фото и видео » Авто центр ру
Какой бы качественной и устойчивой ни была ваша КПП на ВАЗ 2114, но все они поголовно страдают одной болезнью – дребезжит рычаг.
В основном такая проблема возникает на отметке в 3000 оборотов или при нажатии тормоза.
Когда дребезжит и болтается рычаг передач КПП – это ох, как раздражает. Переключения передач становятся до ужаса неудобными и шумными. В автомобиле ВАЗ 2114 решить данную проблему можно своими руками и оттягивать это дело не стоит. Последствия:
- звенит;
- болтается;
- гремит;
- вибрирует.
Многие владельцы откладывают ремонт на будущее, а, на самом деле, процедура эта нетрудная и достаточно быстро выполнимая. Что делать, если дребезжит и болтается рычаг КПП ВАЗ 2114, мы расскажем в нашей статье. Почему и из-за чего это происходит? Это ошибка ВАЗ-разработчиков. Когда автомобиль движется, металлическая втулка, которая соединяет тягу и рычаг, начинает соприкасаться с краями тяги. От этого металл и издаёт звук, потому что болтается. Также размер втулки не соответствует норме. Так что вам необходимо сделать её короче, дабы она не доставала до краёв и, таким образом, вы избавитесь от появившихся неудобств в КПП ВАЗ 2114.
Ручка КПП машины ВАЗ 2114
Как устранить дребезжание и болтание
Ремонт такого типа не занимает много времени и не обойдётся вам потраченными большими суммами. В обмен, вы ещё и получите несколько дополнительных плюсов:
- плавное переключение передач;
- на холостых рычаг перестанет дёргаться и вибрировать;
- при увеличении скорости исчезнет неприятный звук;
- рычаг станет более тугим и зафиксированным.
Инструментарий
Приготовьте следующее:
- ключ на 13;
- изолента;
- болгарка, наждак;
- смазка;
- линейка.
Инструкция
- Первое в списке, что вы должны сделать – это поднять или снять кожух на ручке переключения передач.
Откручиваем ключом гайку тяги
- Открутите ключом гайку.
- Снимите тягу вместе с ручкой.
- Вытащите втулку.
- Потом снимите все пластиковые втулки, а основную металлическую очистите от загрязнений.
- Возьмите линейку и от краёв отмерьте 1-3 мм.
 Проведите линию.
Проведите линию. - По нарисованной линии, обмотайте изолентой. И приступайте к стачиванию того, что расположено выше.
- Полностью снимите всё лишнее болгаркой или ещё можно с помощью наждака.
- Вставьте втулку на место, поставьте тягу и ручку на место, закрутите гайку и оденьте кожух.
- Не забудьте для плавности передач КПП ВАЗ 2114 нанести смазку там, где это необходимо.
Смазка ОЙЛРАЙТ Шрус-4
Готово, ремонт закончен. Теперь переходы передач – это одно наслаждение!
Так что, если в будущем у вас или у ваших знакомых возникнет подобная проблема, совершенно не стоит бить тревогу, всё легко исправляется. Но также и не рекомендуется затягивать с ремонтом надолго, потому что это как минимум вредит вашим нервам и отвлекает на дороге.
Видео «Как устранить дребезг рычага КПП»
мРНК, кодирующих IL-12 и устойчивый к приманке вариант IL-18, совместно создают Т-клетки для эффективной внутриопухолевой адоптивной иммунотерапии
Коннор Р. С., Кавалекар О.У., Гассеми С., Милоне М.К. Иммунотерапия CAR Т-клетками рака человека. Наука. 2018; 359:1361–1365. doi: 10.1126/science.aar6711. [PubMed] [CrossRef] [Google Scholar]
С., Кавалекар О.У., Гассеми С., Милоне М.К. Иммунотерапия CAR Т-клетками рака человека. Наука. 2018; 359:1361–1365. doi: 10.1126/science.aar6711. [PubMed] [CrossRef] [Google Scholar]
2. Янг Р.М., Энгель Н.В., Услу У., Велльхаузен Н., Джун К.Х. Рак Дисков; 2022. Т-клеточная терапия CAR следующего поколения. CD-21-1683. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Розенберг С.А., Ян Дж.К., Шерри Р.М., Каммула У.С., Хьюз М.С., Фан Г.К., Цитрин Д.Е., Рестифо Н.П., Роббинс П.Ф., Вундерлих Дж.Р. и др. Устойчивые полные ответы у пациентов с метастатической меланомой, получавших интенсивное предварительное лечение с использованием иммунотерапии с переносом Т-клеток. клин. Рак Рез. 2011;17:4550–4557. doi: 10.1158/1078-0432.CCR-11-0116. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Дадли М.Е., Гросс К.А., Somerville R.P.T., Хонг Ю., Шауб Н.П., Розати С.Ф., Уайт Д.Е., Натан Д., Рестифо Н.П., Стейнберг С.М. , и другие. Рандомизированное исследование по дизайну отбора, в котором оценивают CD8 + -обогащенные лимфоциты по сравнению с неотобранными инфильтрирующими опухоль лимфоцитами для адоптивной клеточной терапии для пациентов с меланомой. Дж. Клин. Онкол. 2013;31:2152–2159. doi: 10.1200/JCO.2012.46.6441. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Дж. Клин. Онкол. 2013;31:2152–2159. doi: 10.1200/JCO.2012.46.6441. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
и другие. Исследование фазы II терапии опухоль-инфильтрирующими лимфоцитами эпителиального рака, связанного с вирусом папилломы человека. клин. Рак Рез. 2019;25:1486–1493. doi: 10.1158/1078-0432.CCR-18-2722. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Robbins P.F., Kassim S.H., Tran T.L.N., Crystal J.S., Morgan R.A., Feldman S.A., Yang J.C., Dudley M.E., Wunderlich J.R., Sherry R.M., et al. Пилотное испытание с использованием лимфоцитов, генетически сконструированных с NY-ESO-1-реактивным Т-клеточным рецептором: долгосрочное наблюдение и корреляция с реакцией. клин. Рак Рез. 2015;21:1019–1027. doi: 10.1158/1078-0432.CCR-14-2708. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Доран С.Л., Стеванович С., Адхикари С., Гартнер Дж.Дж., Цзя Л., Квонг М.Л.М., Факин В.К., Хьюитт С.М., Шерри Р.М., Ян J.C. и др. Генная терапия Т-клеточного рецептора эпителиального рака, связанного с папилломавирусом человека: первое исследование фазы I/II на людях.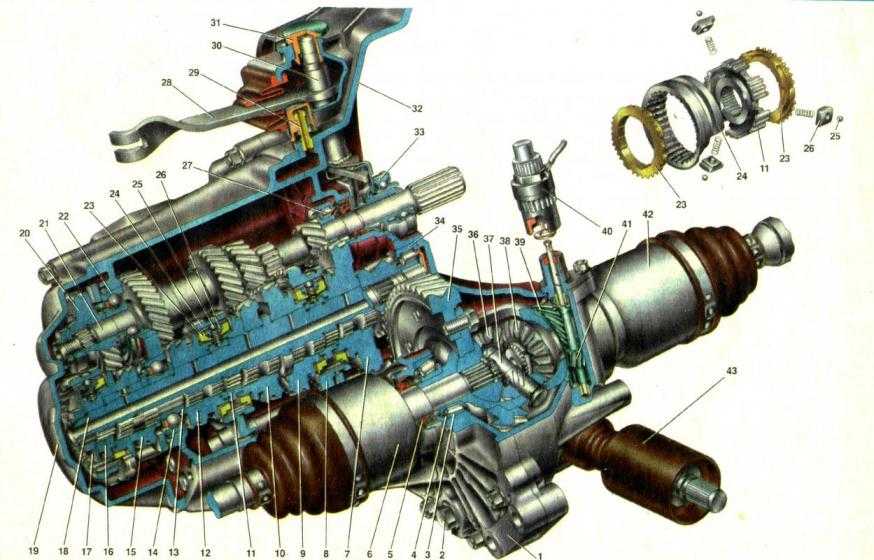 Дж. Клин. Онкол. 2019;37:2759–2768. doi: 10.1200/JCO.18.02424. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Дж. Клин. Онкол. 2019;37:2759–2768. doi: 10.1200/JCO.18.02424. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Рапопорт А.П., Штадтмауэр Э.А., Биндер-Шолль Г.К., Голубева О., Фогль Д.Т., Лейси С.Ф., Бадрос А.З., Гарфолл А., Вайс Б. , Финклештейн Дж. и др. NY-ESO-1-специфические TCR-инженерные Т-клетки опосредуют устойчивые антиген-специфические противоопухолевые эффекты при миеломе. Нац. Мед. 2015;21:914–921. дои: 10.1038/NM.3910. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Абдин С.М., Пааш Д., Морган М., Лахманн Н. CAR и не только: адаптация клеточной терапии на основе макрофагов для борьбы с солидными злокачественными новообразованиями. Дж. Иммунотер. Рак. 2021;9:e002741. doi: 10.1136/jitc-2021-002741. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
10. Стефан М.Т., Пономарев В., Брентдженс Р.Дж., Чанг А.Х., Добренков К.В., Хеллер Г., Саделайн М. Т-клеточный кодируемый CD80 и 4- 1BBL вызывают ауто- и транскостимуляцию, что приводит к сильному отторжению опухоли. Нац. Мед. 2007; 13:1440–1449. doi: 10.1038/nm1676. [PubMed] [CrossRef] [Google Scholar]
Нац. Мед. 2007; 13:1440–1449. doi: 10.1038/nm1676. [PubMed] [CrossRef] [Google Scholar]
11. Дахер М., Басар Р., Гокдемир Э., Баран Н., Упрети Н., Нуньес Кортес А.К., Мендт М., Кербауи Л.Н., Банерджи П.П., Шэнли М. ., и другие. Нацеливание на контрольную точку цитокинов повышает приспособленность армированных CAR-NK клеток пуповинной крови. Кровь. 2021; 137: 624–636. doi: 10.1182/blod.2020007748. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Еку О.О., Пурдон Т.Дж., Конеру М., Сприггс Д., Брентдженс Р.Дж. Бронированные CAR Т-клетки повышают противоопухолевую эффективность и преодолевают микроокружение опухоли. науч. Отчет 2017;7:10541. doi: 10.1038/s41598-017-10940-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Yeku O.O., Brentjens R.J. Бронированные Т-клетки CAR: использование цитокинов и провоспалительных лигандов для повышения противоопухолевой эффективности Т-клеток CAR. Биохим. соц. Транс. 2016; 44:412–418. doi: 10.1042/BST20150291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Zhang L., Morgan R.A., Beane J.D., Zheng Z., Dudley M.E., Kassim S.H., Nahvi A.V., Ngo L.T., Sherry R.M., Phan G.Q., et al. Инфильтрирующие опухоль лимфоциты, генетически сконструированные с индуцируемым геном, кодирующим интерлейкин-12, для иммунотерапии метастатической меланомы. клин. Рак Рез. 2015;21:2278–2288. doi: 10.1158/1078-0432.CCR-14-2085. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Бонини С., Мондино А. Адаптивная Т-клеточная терапия рака: эра инженерных Т-клеток. Евро. Дж. Иммунол. 2015;45:2457–2469. doi: 10.1002/eji.201545552. [PubMed] [CrossRef] [Google Scholar]
16. Zhao Y., Moon E., Carpenito C., Paulos C.M., Liu X., Brennan A.L., Chew A., Carroll R.G., Scholler J., Levine B.L., и другие. Множественные инъекции электропорированных аутологичных Т-клеток, экспрессирующих химерный антигенный рецептор, опосредуют регрессию диссеминированной опухоли человека. Рак Рез. 2010;70:9053–9061. doi: 10.1158/0008-5472.CAN-10-2880. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2010;70:9053–9061. doi: 10.1158/0008-5472.CAN-10-2880. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Etxeberria I., Olivera I., Bolanos E., Cirella A., Teijeira Á., Berraondo P., Melero I. Разработка бионических Т-клеток : сигнал 1, сигнал 2, сигнал 3, перепрограммирование и снятие тормозных механизмов. Клетка. Мол. Иммунол. 2020; 17: 576–586. doi: 10.1038/s41423-020-0464-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Del Vecchio M., Bajetta E., Canova S., Lotze M.T., Wesa A., Parmiani G., Anichini A. Интерлейкин-12: биологические свойства и клиническое применение. клин. Рак Рез. 2007; 13:4677–4685. doi: 10.1158/1078-0432.CCR-07-0776. [PubMed] [CrossRef] [Google Scholar]
19. Цирелла А., Лури-Рей К., ди Трани К.А., Тейхейра А., Оливера И., Боланьос Э., Кастаньон Э., Паленсия Б., Брокко Д. ., Фернандес-Сендин М. и др. Новые стратегии использования интерлейкина-12 в иммунотерапии рака. Фармакол. тер. 2022;239:108189. doi: 10. 1016/j.pharmthera.2022.108189. [PubMed] [CrossRef] [Google Scholar]
1016/j.pharmthera.2022.108189. [PubMed] [CrossRef] [Google Scholar]
20. Керкар С.П., Гольдшмид Р.С., Мурански П., Чиннасами Д., Ю З., Регер Р.Н., Леонарди А.Дж., Морган Р.А., Ван Э., Маринкола Ф.М. и др. . IL-12 запускает программные изменения в дисфункциональных клетках миелоидного происхождения в опухолях мышей. Дж. Клин. Вкладывать деньги. 2011; 121:4746–4757. doi: 10.1172/JCI58814. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
21. Novick D., Kim S., Kaplanski G., Dinarello C.A. Интерлейкин-18 больше, чем цитокин Th2. Семин. Иммунол. 2013;25:439–448. doi: 10.1016/j.smim.2013.10.014. [PubMed] [CrossRef] [Google Scholar]
22. Дрейкс Д.Дж., Рафик С., Пурдон Т.Дж., Лопес А.В., Чандран С.С., Клебанофф К.А., Брентдженс Р.Дж. Оптимизация Т-клеток, модифицированных Т-клеточным рецептором, для лечения рака. Рак Иммунол. рез. 2020; 8: 743–755. doi: 10.1158/2326-6066.CIR-19-0910. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Chaix J. , Tessmer M.S., Hoebe K., Fuséri N., Ryffel B., Dalod M., Alexopoulou L., Beutler B., Brossay L., Vivier E., Walzer T. Передний край: праймирование NK-клеток IL-18. Дж. Иммунол. 2008; 181:1627–1631. дои: 10.4049/jиммунол.181.3.1627. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Tessmer M.S., Hoebe K., Fuséri N., Ryffel B., Dalod M., Alexopoulou L., Beutler B., Brossay L., Vivier E., Walzer T. Передний край: праймирование NK-клеток IL-18. Дж. Иммунол. 2008; 181:1627–1631. дои: 10.4049/jиммунол.181.3.1627. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Цирелла А., Боланос Э., Ди Трани К.А., де Андреа К.Е., Санчес-Грегорио С., Эксеберрия И., Гонсалес-Гомарис Дж. , Оливера И., Брокко Д., Глез-Ваз Дж. и др. Внутриопухолевый перенос генов мРНК, кодирующих интерлейкин-12, в сочетании с интерлейкином-18, устойчивым к приманке, улучшает местный и системный противоопухолевый иммунитет. Рак Иммунол. рез. 2022 г.: 10.1158/2326-6066. СИР-22-0373. [PubMed] [CrossRef] [Академия Google]
25. Детри С., Андрис Дж., Блох Ю., Габай С., Клэнси Д.М., Саввидес С.Н. Структурные основы секвестрации человеческого IL-18 белком-приманкой, связывающим IL-18, при воспалении и опухолевом иммунитете. Дж. Биол. хим. 2022;298:101908. doi: 10.1016/j.jbc.2022. 101908. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
101908. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Zhou T., Damsky W., Weizman O.-E., McGeary M.K., Hartmann K.P., Rosen C.E., Fischer S., Jackson R. , Flavell R.A., Wang J., et al. IL-18BP является секретируемым иммунным контрольным пунктом и барьером для иммунотерапии IL-18. Природа. 2020;583:609–614. doi: 10.1038/s41586-020-2422-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Carbotti G., Barisione G., Orengo A.M., Brizzolara A., Airoldi I., Bagnoli M., Pinciroli P., Mezzanzanica D., Центуриони М.Г., Фабби М., Феррини С. Антагонист IL-18 IL-18-связывающий белок вырабатывается в микроокружении рака яичников человека. клин. Рак Рез. 2013;19:4611–4620. doi: 10.1158/1078-0432.CCR-13-0568. [PubMed] [CrossRef] [Google Scholar]
28. Hu B., Ren J., Luo Y., Keith B., Young R.M., Scholler J., Zhao Y., June C.H. Усиление противоопухолевого иммунитета CAR Т-клетками человека и мыши, секретирующими IL-18. Cell Rep. 2017; 20:3025–3033. doi: 10.1016/j.celrep.2017.09.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.celrep.2017.09.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Etxeberria I., Bolanos E., Quetglas J.I., Gros A., Villanueva A., Palomero J., Sánchez-Paulete A.R., Piulats J.M., Матиас-Гиу X., Оливера И. и др. Внутриопухолевый адоптивный перенос мРНК IL-12, временно сконструированный противоопухолевыми CD8+ Т-клетками. Раковая клетка. 2019;36:613–629.e7. doi: 10.1016/j.ccell.2019.10.006. [PubMed] [CrossRef] [Google Scholar]
30. Мелеро И., Кастанон Э., Альварес М., Шампиат С., Марабель А. Внутриопухолевое введение и нацеливание на опухолевую ткань иммунотерапии рака. Нац. Преподобный Клин. Онкол. 2021; 18: 558–576. doi: 10.1038/s41571-021-00507-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Черкасский Л., Хоу З., Амадор-Молина А., Адусумилли П.С. Региональная терапия Т-клетками CAR: ключ к системному иммунитету при солидных опухолях. Раковая клетка. 2022; 40: 569–574. doi: 10.1016/j.ccell.2022.04.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Майзнер Р.Г., Рамакришна С., Йом К.В., Патель С., Чиннасами Х., Шульц Л.М., Ричардс Р.М., Цзян Л., Барсан В. , Манкузи Р. и др. Т-клеточная терапия GD2-CAR при диффузных глиомах срединной линии с мутацией h4K27M. Природа. 2022;603:934–941. doi: 10.1038/s41586-022-04489-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Майзнер Р.Г., Рамакришна С., Йом К.В., Патель С., Чиннасами Х., Шульц Л.М., Ричардс Р.М., Цзян Л., Барсан В. , Манкузи Р. и др. Т-клеточная терапия GD2-CAR при диффузных глиомах срединной линии с мутацией h4K27M. Природа. 2022;603:934–941. doi: 10.1038/s41586-022-04489-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Браун К.Е., Ализаде Д., Старр Р., Венг Л., Вагнер Дж.Р., Наранхо А., Остберг Дж.Р., Бланшар М.С., Килпатрик Дж. , Симпсон Дж. и др. Регрессия глиобластомы после Т-клеточной терапии химерными антигенными рецепторами. Н. англ. Дж. Мед. 2016; 375: 2561–2569. doi: 10.1056/NEJMoa1610497. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Halton E., et al. Фаза I испытания регионарной терапии CAR Т-клетками, нацеленной на мезотелин, у пациентов со злокачественным заболеванием плевры в сочетании с пембролизумабом, препятствующим PD-1. Рак Дисков. 2021; 11: 2748–2763. дои: 10.1158/2159-8290.CD-21-0407. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
35. Overwijk W.W., Theoret M.R., Finkelstein S.E., Surman D.R., de Jong L.A., Vyth-Dreese F.A., Dellemijn T.A., Antony P.A., Spiess P.J., Palmer округ Колумбия и др. Регрессия опухоли и аутоиммунитет после изменения функционально толерантного состояния аутореактивных CD8+ Т-клеток. Дж. Эксп. Мед. 2003; 198: 569–580. doi: 10.1084/jem.20030590. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Overwijk W.W., Theoret M.R., Finkelstein S.E., Surman D.R., de Jong L.A., Vyth-Dreese F.A., Dellemijn T.A., Antony P.A., Spiess P.J., Palmer округ Колумбия и др. Регрессия опухоли и аутоиммунитет после изменения функционально толерантного состояния аутореактивных CD8+ Т-клеток. Дж. Эксп. Мед. 2003; 198: 569–580. doi: 10.1084/jem.20030590. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Клебанофф К.А., Финкельштейн С.Е., Сурман Д.Р., Лихтман М.К., Гаттинони Л., Теорет М.Р., Гревал Н., Списс П.Дж., Энтони П.А., Палмер Д.К. , и другие. ИЛ-15 усиливает противоопухолевую активность опухоле-реактивных CD8 + Т-клеток in vivo. проц. Натл. акад. науч. США. 2004;101:1969–1974. doi: 10.1073/pnas.0307298101. –1974. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Hildner K., Edelson B.T., Purtha W.E., Diamond M., Matsushita H., Kohyama M., Calderon B., Schraml B.U., Unanue E.R. , Даймонд М.С. и др. Дефицит Batf3 показывает критическую роль CD8α + дендритных клеток в цитотоксическом Т-клеточном иммунитете. Наука. 2008; 322:1097–1100. doi: 10.1126/science.1164206. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Наука. 2008; 322:1097–1100. doi: 10.1126/science.1164206. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Woo S.-R., Fuertes M.B., Corrales L., Spranger S., Furdyna M.J., Leung M.Y.K., Duggan R., Wang Y. , Barber G.N., Fitzgerald K.A., et al. STING-зависимое определение цитозольной ДНК опосредует распознавание иммуногенных опухолей врожденным иммунитетом. Иммунитет. 2014;41:830–842. doi: 10.1016/j.immuni.2014.10.017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Castle J.C., Kreiter S., Diekmann J., Löwer M., van de Roemer N., de Graaf J., Selmi A., Diken M., Boegel S., Paret C., et al. Использование мутанома для противоопухолевой вакцинации. Рак Рез. 2012;72:1081–1091. doi: 10.1158/0008-5472.CAN-11-3722. [PubMed] [CrossRef] [Google Scholar]
40. Peng L., Chen Z., Chen Y., Wang X., Tang N. MIR155HG является прогностическим биомаркером и связан с иммунной инфильтрацией и экспрессией молекул иммунных контрольных точек во многих раки. Рак Мед. 2019;8:7161–7173. doi: 10.1002/CAM4.2583. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Рак Мед. 2019;8:7161–7173. doi: 10.1002/CAM4.2583. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Сато Т., Тераи М., Тамура Ю., Алексеев В., Мастранжело М.Дж., Селван С.Р. Интерлейкин 10 в микроокружении опухоли: мишень для противоопухолевой иммунотерапии. Иммунол. рез. 2011;51:170–182. doi: 10.1007/s12026-011-8262-6. [PubMed] [CrossRef] [Google Scholar]
42. Riese M.J., Wang L.C.S., Moon E.K., Joshi R.P., Ranganathan A., June C.H., Koretzky G.A., Albelda S.M. Усиленные эффекторные ответы в активированных CD8+ Т-клетках с дефицитом диацилглицеролкиназ. Рак Рез. 2013;73:3566–3577. doi: 10.1158/0008-5472.CAN-12-3874. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Пирс Э.Л., Маллен А.С., Мартинс Г.А., Кравчик С.М., Хатчинс А.С., Зедиак В.П., Баника М., ДиЧиоччио С.Б., Гросс Д.А., Мао С.А., и соавт. Контроль функции эффекторных CD8 + Т-клеток с помощью транскрипционного фактора эомезодермина. Наука. 2003; 302:1041–1043. doi: 10.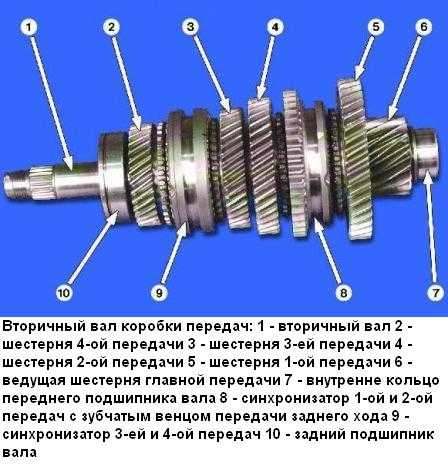 1126/science.10
1126/science.10
. [PubMed] [CrossRef] [Google Scholar]
44. Intlekofer A.M., Takemoto N., Wherry E.J., Longworth S.A., Northrup J.T., Palanivel V.R., Mullen A.C., Gasink C.R., Kaech S.M., Miller J.D., et al. Судьба эффекторных CD8+ и Т-клеток памяти в сочетании с T-bet и эомезодермином. Нац. Иммунол. 2005; 6: 1236–1244. дои: 10.1038/ni1268. [PubMed] [CrossRef] [Академия Google]
45. Ван ден Стин П., Радд П.М., Двек Р.А., Опденаккер Г. Концепции и принципы О-связанного гликозилирования. крит. Преподобный Биохим. Мол. биол. 1998; 33: 151–208. doi: 10.1080/10409239891204198. [PubMed] [CrossRef] [Google Scholar]
46. Fuhlbrigge R.C., King S.L., Sackstein R., Kupper T.S. CD43 представляет собой лиганд для E-селектина на CLA+ Т-клетках человека. Кровь. 2006; 107:1421–1426. doi: 10.1182/blood-2005-05-2112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Мацумото М., Атараши К., Умемото Э., Фурукава Ю., Шигета А., Миясака М., Хирата Т. CD43 функционирует как лиганд для E-селектина на активированных Т-клетках. Дж. Иммунол. 2005; 175:8042–8050. дои: 10.4049/иммунол.175.12.8042. [PubMed] [CrossRef] [Google Scholar]
Дж. Иммунол. 2005; 175:8042–8050. дои: 10.4049/иммунол.175.12.8042. [PubMed] [CrossRef] [Google Scholar]
, Оуян Дж. и др. Взаимодействия лектин-рецептор, зависящие от гликозилирования, сохраняют ангиогенез в анти-VEGF-резистентных опухолях. Клетка. 2014; 156:744–758. doi: 10.1016/j.cell.2014.01.043. [PubMed] [CrossRef] [Google Scholar]
49. Foxall C., Watson S.R., Dowbenko D., Fennie C., Lasky L.A., Kiso M., Hasegawa A., Asa D., Brandley B.K. Три члена семейства рецепторов селектина распознают общий углеводный эпитоп, сиалиловый олигосахарид Льюиса (х). J. Cell Biol. 1992;117:895–902. doi: 10.1083/jcb.117.4.895. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Лоуренс М.Б., Спрингер Т.А. Нейтрофилы катаются на Е-селектине. Дж. Иммунол. 1993; 151:6338–6346. [PubMed] [Google Scholar]
51. Abbassi O., Kishimoto T.K., McIntire L.V., Anderson D.C., Smith C.W. E-селектин поддерживает свертывание нейтрофилов in vitro в условиях потока. Дж. Клин. Вкладывать деньги. 1993; 92: 2719–2730. doi: 10.1172/JCI116889. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вкладывать деньги. 1993; 92: 2719–2730. doi: 10.1172/JCI116889. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Колумам Г.А., Томас С., Томпсон Л.Дж., Спрент Дж., Мурали-Кришна К. Интерфероны типа I действуют непосредственно на Т-клетки CD8, обеспечивая клональную экспансию и формирование памяти в ответ на вирусную инфекцию. Дж. Эксп. Мед. 2005; 202: 637–650. doi: 10.1084/jem.20050821. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
53. Дулаби Х., Масуми Э., Растин М., Фулади Азарнамини А., Эсмаили С.-А., Махмуди М. Роль Th32 клеток, от восстановления тканей до прогрессирования рака. Цитокин. 2022;149:155749. doi: 10.1016/j.cyto.2021.155749. [PubMed] [CrossRef] [Google Scholar]
54. Hailemichael Y., Johnson D.H., Abdel-Wahab N., Foo W.C., Bentebibel S.-E., Daher M., Haymaker C., Wani K., Saberian С., Огата Д. и соавт. Блокада интерлейкина-6 устраняет токсичность иммунотерапии и способствует иммунитету к опухолям. Раковая клетка. 2022;40:509–523. e6. doi: 10.1016/j.ccell.2022.04.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
e6. doi: 10.1016/j.ccell.2022.04.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Naing A., Infante J.R., Papadopoulos K.P., Chan I.H., Shen C., Ratti N.P., Rojo B., Autio K.A., Wong D.J., Patel М.Р. и др. Пегилированный ИЛ-10 (пегилодекакин) индуцирует активацию системного иммунитета, активацию CD8+ Т-клеток и экспансию поликлональных Т-клеток у онкологических больных. Раковая клетка. 2018; 34: 775–791.e3. doi: 10.1016/j.ccell.2018.10.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Mocellin S., Marincola F.M., Young H.A. Интерлейкин-10 и иммунный ответ против рака: контрапункт. Дж. Лейкок. биол. 2005; 78: 1043–1051. doi: 10.1189/jlb.0705358. [PubMed] [CrossRef] [Google Scholar]
57. Ji Y., Gattinoni L. miR-155 снимает тормоза с противоопухолевых Т-клеток. Онкоиммунология. 2015;4:e1026533. doi: 10.1080/2162402X.2015.1026533. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Condé C., Gloire G., Piette J. Ферментативная и неферментативная активность SHIP-1 в передаче сигнала и раке. Биохим. Фармакол. 2011;82:1320–1334. doi: 10.1016/j.bcp.2011.05.031. [PubMed] [CrossRef] [Google Scholar]
Ферментативная и неферментативная активность SHIP-1 в передаче сигнала и раке. Биохим. Фармакол. 2011;82:1320–1334. doi: 10.1016/j.bcp.2011.05.031. [PubMed] [CrossRef] [Google Scholar]
59. Ян Дж. К., Розенберг С. А. Достижения в иммунологии. Академическая пресса; 2016. Адаптивная Т-клеточная терапия рака; стр. 279–294. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Fernandez-Poma S.M., Salas-Benito D., Lozano T., Casares N., Riezu-Boj J.-I., Mancheño U. , Элизальде Э., Алиньяни Д., Зубельдиа Н., Отано И. и др. Увеличение инфильтрирующих опухоль CD8 + Т-клеток, экспрессирующих PD-1, повышает эффективность адоптивной Т-клеточной терапии. Рак Рез. 2017;77:3672–3684. doi: 10.1158/0008-5472.CAN-17-0236. [PubMed] [CrossRef] [Академия Google]
61. Конде Э., Верчер Э., Сориа-Кастельяно М., Суарес-Олмос Х., Манченьо У., Элизальде Э., Родригес М.Л., Глез-Ваз Х., Касарес Н., Родригес-Гарсия Э. , и другие. Распространение эпитопа, вызванное совместным действием клеток CART и фармакологической стимуляцией STING, противодействует ускользанию опухоли через варианты с потерей антигена. Дж. Иммунотер. Рак. 2021;9:e003351. doi: 10.1136/jitc-2021-003351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Иммунотер. Рак. 2021;9:e003351. doi: 10.1136/jitc-2021-003351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Целикас Л., Шампиат С., Шет Р.А., Йевич С., Аммари С., Дешам Ф., Фархан С., Ру С., Сусини С., Муро С. и др. Интервенционная радиология для местной иммунотерапии в онкологии. клин. Рак Рез. 2021;27:2698–2705. doi: 10.1158/1078-0432.CCR-19-4073. [PubMed] [CrossRef] [Google Scholar]
63. Sun R., Gao D.S., Shoush J., Lu B. Семейство IL-1 в онкогенезе и противоопухолевом иммунитете. Семин. Рак биол. 2022; 86: 280–295. doi: 10.1016/j.semcancer.2022.05.002. [PubMed] [CrossRef] [Google Scholar]
64. Хайме-Санчес П., Уранга-Мурильо И., Агило Н., Хуили С.К., Ариас М.А., Санчо Д., Пардо Дж. Гибель клеток, вызванная цитотоксическими CD8 + Т-клетки являются иммуногенными и запускают каспазо-3-зависимый распространенный иммунитет против эндогенных опухолевых антигенов. Дж. Иммунотер. Рак. 2020;8:e000528. doi: 10.1136/jitc-2020-000528. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Минут Л., Тейхейра А., Санчес-Паулет А.Р., Очоа М.К., Альварес М., Отано И., Эксеберррия И., Боланьос Э., Аспиликуэта А., Гараса С. и др. Клеточная цитотоксичность представляет собой форму иммуногенной гибели клеток. Дж. Иммунотер. Рак. 2020;8:e000325. doi: 10.1136/jitc-2019-000325. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Минут Л., Тейхейра А., Санчес-Паулет А.Р., Очоа М.К., Альварес М., Отано И., Эксеберррия И., Боланьос Э., Аспиликуэта А., Гараса С. и др. Клеточная цитотоксичность представляет собой форму иммуногенной гибели клеток. Дж. Иммунотер. Рак. 2020;8:e000325. doi: 10.1136/jitc-2019-000325. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Санчес-Паулете А.Р., Тейхейра А., Куэто Ф.Дж., Гараса С., Перес-Грация Х.Л., Санчес-Арраес А., Санчо Д., Мелеро И. Перекрестная презентация антигена и перекрестная затравка Т-клеток в иммунологии рака и иммунотерапии. Анна. Онкол. 2017;28:xii44–xii55. дои: 10.1093/annonc/mdx237. [PubMed] [CrossRef] [Google Scholar]
67. ван Коойк Ю., Рабинович Г.А. Белково-гликановые взаимодействия в контроле врожденных и адаптивных иммунных реакций. Нац. Иммунол. 2008; 9: 593–601. doi: 10.1038/ni.f.203. [PubMed] [CrossRef] [Google Scholar]
68. Айрес Д.Дж., Йошида М., Ричардсон С.К., Бай М., Лю Л., Морено Р., Лазар А.Дж.Ф., Вик Дж.А., Рич Б. Е., Мерфи Г. и др. др. Транспортировка Т-клеток играет важную роль в противоопухолевом иммунитете. лаборатория Вкладывать деньги. 2019; 99: 85–92. doi: 10.1038/s41374-018-0124-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Е., Мерфи Г. и др. др. Транспортировка Т-клеток играет важную роль в противоопухолевом иммунитете. лаборатория Вкладывать деньги. 2019; 99: 85–92. doi: 10.1038/s41374-018-0124-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Hervas-Stubbs S., Mancheño U., Riezu-Boj J.-I., Larraga A., Ochoa M.C., Alignani D., Alfaro К., Моралес-Кастресана А., Гонсалес И., Ларреа Э. и др. Примирование Т-клеток CD8 в присутствии IFN-α придает ЦТЛ улучшенную чувствительность к гомеостатическим цитокинам и антигенам отзыва: важные черты для адоптивной Т-клеточной терапии. Дж. Иммунол. 2012;189:3299–3310. doi: 10.4049/jimmunol.1102495. [PubMed] [CrossRef] [Академия Google]
70. Вальдманн Т.А., Дюбуа С., Милькович М.Д., Конлон К.С. ИЛ-15 в комбинированной иммунотерапии рака. Передний. Иммунол. 2020;11:868. doi: 10.3389/fimmu.2020.00868. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Davey G.M., Starr R., Cornish A.L., Burghardt J.T., Alexander W.S. , Carbone F.R., Surh C.D., Heath W.R. SOCS-1 регулирует IL-15 – гомеостатическая пролиферация антиген-наивных Т-клеток CD8, ограничивающая их аутоиммунный потенциал. Дж. Эксп. Мед. 2005;202:1099–1108. doi: 10.1084/jem.20050003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Carbone F.R., Surh C.D., Heath W.R. SOCS-1 регулирует IL-15 – гомеостатическая пролиферация антиген-наивных Т-клеток CD8, ограничивающая их аутоиммунный потенциал. Дж. Эксп. Мед. 2005;202:1099–1108. doi: 10.1084/jem.20050003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Dudda J.C., Salaun B., Ji Y., Palmer D.C., Monnot G.C., Merck E., Boudousquie C., Utzschneider DT, Escobar TM, Перре Р. и др. МикроРНК-155 необходима для ответа эффекторных cd8+ Т-клеток на вирусную инфекцию и рак. Иммунитет. 2013; 38: 742–753. doi: 10.1016/j.immuni.2012.12.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Møller S.H., Hsueh P.-C., Yu Y.-R., Zhang L., Ho P.-C. Метаболические программы адаптируют Т-клеточный иммунитет к вирусным инфекциям, раку и старению. Клеточный метаб. 2022; 34: 378–395. doi: 10.1016/j.cmet.2022.02.003. [PubMed] [CrossRef] [Google Scholar]
74. Кавалекар О.У., О’Коннор Р.С., Фрайетта Дж.А., Го Л., Макгеттиган С.Е., Поузи А. Д., Патель П.Р., Гедан С., Шоллер Дж., Кит Б., и другие. Различная передача сигналов корецепторов регулирует определенные пути метаболизма и влияет на развитие памяти в CAR Т-клетках. Иммунитет. 2016;44:380–390. doi: 10.1016/j.immuni.2016.01.021. [PubMed] [CrossRef] [Google Scholar]
Д., Патель П.Р., Гедан С., Шоллер Дж., Кит Б., и другие. Различная передача сигналов корецепторов регулирует определенные пути метаболизма и влияет на развитие памяти в CAR Т-клетках. Иммунитет. 2016;44:380–390. doi: 10.1016/j.immuni.2016.01.021. [PubMed] [CrossRef] [Google Scholar]
75. Teijeira A., Garasa S., Etxeberria I., Gato-Cañas M., Melero I., Delgoffe G.M. Метаболические последствия костимуляции Т-клеток в противораковом иммунитете. Рак Иммунол. Рез. 2019;7:1564–1569. doi: 10.1158/2326-6066.CIR-19-0115. [PubMed] [CrossRef] [Google Scholar]
76. Лабиано С., Палазон А., Мелеро И. Регуляция иммунного ответа в микроокружении опухоли при гипоксии. Семин. Онкол. 2015;42:378–386. doi: 10.1053/j.seminoncol.2015.02.009. [PubMed] [CrossRef] [Google Scholar]
77. Engelhardt J.J., Boldajipour B., Beemiller P., Pandurangi P., Sorensen C., Werb Z., Egeblad M., Krummel M.F. Маргинирующие дендритные клетки микроокружения опухоли перекрестно представляют опухолевые антигены и стабильно взаимодействуют с опухолеспецифическими Т-клетками. Раковая клетка. 2012;21:402–417. doi: 10.1016/j.ccr.2012.01.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Раковая клетка. 2012;21:402–417. doi: 10.1016/j.ccr.2012.01.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Zitvogel L., Kroemer G. CD103+ дендритные клетки, продуцирующие интерлейкин-12 в противоопухолевом иммунном надзоре. Раковая клетка. 2014; 26: 591–593. doi: 10.1016/j.ccell.2014.10.008. [PubMed] [CrossRef] [Google Scholar]
79. Мартинес-Сабадель А., Аренас Э.Дж., Аррибас Дж. Передача сигналов IFNγ в естественных и индуцированных терапией противоопухолевых реакциях. клин. Рак Рез. 2022; 28: 1243–1249. doi: 10.1158/1078-0432.CCR-21-3226. [PubMed] [CrossRef] [Google Scholar]
80. Пашен А., Мелеро И., Рибас А. Центральная роль путей представления антигена и интерферона-γ в устойчивости к блокаде иммунных контрольных точек. Анну. Преподобный Рак Биол. 2022; 6: 85–102. doi: 10.1146/annurev-cancerbio-070220-111016. [Перекрестная ссылка] [Академия Google]
81. Рожман П., Швайгер У. Толерогенная роль фактора роста цитокинов IFN-γ Rev. 2018; 41:40–53. doi: 10.1016/j.cytogfr.2018.04.001. [PubMed] [CrossRef] [Google Scholar]
2018; 41:40–53. doi: 10.1016/j.cytogfr.2018.04.001. [PubMed] [CrossRef] [Google Scholar]
82. Фишер Д.Т., Чен К., Скицки Дж.Дж., Мухитч Дж.Б., Чжоу Л., Аппенхаймер М.М., Вардам Т.Д., Вайс Э.Л., Пассанезе Дж., Ван В.-К. , и другие. Передача сигналов IL-6 лицензирует микрососудистые шлюзы опухоли мыши и человека для доставки цитотоксических Т-клеток. Дж. Клин. Вкладывать деньги. 2011; 121:3846–3859. дои: 10.1172/JCI44952. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Хаас А.Р., Таньи Дж.Л., О’Хара М.Х., Гладни В.Л., Лейси С.Ф., Торигиан Д.А., Соулен М.С., Тиан Л., МакГарви М. ., Нельсон А.М. и др. Фаза I исследования лентивирусно-трансдуцированных Т-клеток, модифицированных химерным антигенным рецептором, распознающих мезотелин при прогрессирующем солидном раке. Мол. тер. 2019; 27:1919–1929. doi: 10.1016/j.ymthe.2019.07.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Ди Трани К.А., Цирелла А., Аррисабалага Л., Белла А., Фернандес-Сендин М. , Руссо-Кабрера Дж.С., Гомар К., Оливера И., Боланьос Э., Гонсалес-Гомарис Дж. и др. Внутриполостной адоптивный перенос сконструированных с помощью мРНК IL-12 опухолеспецифических CD8 + Т-клеток уничтожает перитонеальные метастазы на моделях мышей. Онкоиммунология. 2023;12:2147317. doi: 10.1080/2162402X.2022.2147317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Руссо-Кабрера Дж.С., Гомар К., Оливера И., Боланьос Э., Гонсалес-Гомарис Дж. и др. Внутриполостной адоптивный перенос сконструированных с помощью мРНК IL-12 опухолеспецифических CD8 + Т-клеток уничтожает перитонеальные метастазы на моделях мышей. Онкоиммунология. 2023;12:2147317. doi: 10.1080/2162402X.2022.2147317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Вейгелин Б., Боланьос Э., Тейхейра А., Мартинес-Фореро И., Лабиано С., Аспиликуэта А., Моралес-Кастресана А., Кетглас Х.И., Вагена Э., Санчес-Паулет А.Р. и др. . Фокусировка и поддержание ответа противоопухолевого эффекторного киллера ЦТЛ с помощью агониста mAb против CD137. Труды Национальной академии наук. 2015; 112:7551–7556. doi: 10.1073/pnas.1506357112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Bolger A.M., Lohse M., Usadel B. Trimmomatic: гибкий триммер для данных последовательности Illumina. Биоинформатика. 2014;30:2114–2120. дои: 10.1093/биоинформатика/btu170. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Добин А., Дэвис К.А., Шлезингер Ф., Дренков Дж., Залески К., Джа С., Батут П., Чейссон М., Джингерас Т.Р. STAR: сверхбыстрый универсальный выравниватель RNA-seq. Биоинформатика. 2013;29:15–21. doi: 10.1093/биоинформатика/bts635. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Добин А., Дэвис К.А., Шлезингер Ф., Дренков Дж., Залески К., Джа С., Батут П., Чейссон М., Джингерас Т.Р. STAR: сверхбыстрый универсальный выравниватель RNA-seq. Биоинформатика. 2013;29:15–21. doi: 10.1093/биоинформатика/bts635. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Ляо Ю., Смит Г.К., Ши В. featureCounts: эффективная программа общего назначения для сопоставления считываний последовательностей с геномными признаками. Биоинформатика. 2014;30:923–930. doi: 10.1093/биоинформатика/btt656. [PubMed] [CrossRef] [Google Scholar]
89. Vijayasaradhi S., Xu Y., Bouchard B., Houghton A.N. Внутриклеточная сортировка и нацеливание на белки меланосомной мембраны: идентификация сигналов для сортировки белка коричневого локуса человека, gp75. J. Cell Biol. 1995; 130:807–820. doi: 10.1083/JCB.130.4.807. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Хубер В., Кэри В.Дж., Джентльмен Р., Андерс С., Карлсон М., Карвалью Б.С., Браво Х.К., Дэвис С.



 Выпрессуйте наружные кольца подшипников валов и дифференциала из картера сцепления, используя съемники 67.7801.9529 и 67.7801.9530.
Выпрессуйте наружные кольца подшипников валов и дифференциала из картера сцепления, используя съемники 67.7801.9529 и 67.7801.9530. Аналогично спрессовывается подшипник с первичного вала. Затем снимите с вторичного вала ведомые шестерни IV, III, II и I передач и синхронизаторы в сборе в порядке, указанном на рис. 3.14. Снимите стопорное кольцо ступицы синхронизатора I и II передач. Синхронизаторы в сборе спрессуйте на прессе или съемником А. 40005/ 1/ 6. При необходимости разберите синхронизаторы.
Аналогично спрессовывается подшипник с первичного вала. Затем снимите с вторичного вала ведомые шестерни IV, III, II и I передач и синхронизаторы в сборе в порядке, указанном на рис. 3.14. Снимите стопорное кольцо ступицы синхронизатора I и II передач. Синхронизаторы в сборе спрессуйте на прессе или съемником А. 40005/ 1/ 6. При необходимости разберите синхронизаторы. 3.15) с коробки 5 дифференциала;
3.15) с коробки 5 дифференциала;
 В основном такая проблема возникает на отметке в 3000 оборотов или при нажатии тормоза.
В основном такая проблема возникает на отметке в 3000 оборотов или при нажатии тормоза. Проведите линию.
Проведите линию.