Карбон из чего состоит: Что такое карбон или углепластик
Что такое карбон? | Новости Renegade Design
Карбон состоит из тонких прочных кристаллических нитей графита, которые используются для упрочнения материала. Углеродное волокно, которое используется в карбоне может быть тоньше человеческого волоса. Но несмотря на этого обладает прочностью за счет скручивания вместе, как пряжа. Карбон относиться к разряду композиционных материалов, к классу углепластиков, который объединяет в себе несколько тысяч разных рецептур. Этот материал чаще всего встречается на тюнингованных автомобилях на определенных элементах кузова. Как правило, карбоном обтягивают капот, обвес или спойлер. Но важно отметить, что он может применяться в абсолютно различных местах транспорта. Также, его зачастую применяют для дизайна в салоне. Этот материал пользуется спросом из-за своей прочности и легкости. Несмотря на то, что он легче алюминия или стали, он является прочнее металла.
Как изготовляется карбон
Карбон производится в результате химического и механического процесса. Он начинается с вытягивания длинных нитей волокон, а затем их нагревания очень высоких температур. При этом нельзя допускать контакт с кислородом, чтобы не возникло горение волокон. В результате остается волокно, состоящее из длинных, плотно связанных цепочек атомов углерода, и остается лишь несколько не углеродных атомов. Формирование материала состоит из таких этапов:
Он начинается с вытягивания длинных нитей волокон, а затем их нагревания очень высоких температур. При этом нельзя допускать контакт с кислородом, чтобы не возникло горение волокон. В результате остается волокно, состоящее из длинных, плотно связанных цепочек атомов углерода, и остается лишь несколько не углеродных атомов. Формирование материала состоит из таких этапов:
В конечном итоге получает надежная карбоновая пленка, которая отличается прочностью и надежностью. Помимо этого карбон обладает такими характеристиками:
Высокий уровень жесткости.
Прочность и износостойкость.
Стойкость к химическим веществам.
Устойчивость к перепадам температуры.
Низкое тепловое расширение.
Исходя из этого можно сделать вывод, что карбон очень популярен. И чаще всего его используют во многих автомобильных отраслях.
Применение карбона в автомобилях
На сегодняшний день сложно представить себе тюнингованный автомобиль без единой детали в карбоне. Кроме, эстетической стороны этот материал ценен своей практичной стороной. Карбон быстро завоевал популярность в автомобильном мире. То, что раньше было зарезервировано для специальных автомобилей, теперь стало тем, что можно увидеть во многих потребительских спортивных автомобилях и даже некоторых грузовиках. Он служит уникальной дизайнерской особенностью, которую любят многие люди и даже пытаются воспроизвести с помощью виниловых оберток.
Кроме, эстетической стороны этот материал ценен своей практичной стороной. Карбон быстро завоевал популярность в автомобильном мире. То, что раньше было зарезервировано для специальных автомобилей, теперь стало тем, что можно увидеть во многих потребительских спортивных автомобилях и даже некоторых грузовиках. Он служит уникальной дизайнерской особенностью, которую любят многие люди и даже пытаются воспроизвести с помощью виниловых оберток.
Среди преимуществ карбона для автомобилей можно отметить:
помогает защитить покрытие от сколов и царапин;
маскирует все неровности и мелкие дефекты;
возможность применения для металла, пластика и стекла;
срок эксплуатации составляет более 5 лет.
Но важно отметить, что карбон это намного больше, чем просто изделие для косметического декора. На самом деле углеродное волокно обладает структурной жесткостью и легким весом, что делает его одним из лучшим из материалов для любого автомобиля.
Также, стоит отметить, что нет причин, по которым нельзя закрашивать карбон. Но многие производители предпочитают не делать этого, потому что в плетеном углеродном волокне есть что-то красивое. Независимо от того, используется ли он в качестве небольших элементов дизайна, чтобы подчеркнуть автомобиль, или весь автомобиль демонстрирует открытое переплетение, он может стать потрясающим дополнением к любому автомобилю. Это делает его не только практичным, но и красивым.
Как карбон улучшает автомобиль?
С помощью карбона можно легко повторить индивидуальные формы любой детали. Для работы с этим материалом не требуются большие усилия и особые навыки. Карбон можно использовать для создания бесконечного количества форм без потери их структурной жесткости.Его можно сформовать, согнуть и придать любой формы, возможности практически безграничны. Он способен создать новый дизайна автомобиля без огромных вложений.
Ламинация автомобиля карбоном также обладает такими достоинствами:
повышает износостойкость поверхностей;
обеспечивает защиту от атмосферных явлений;
предупреждает образование царапин, сколов и вмятин;
облегчает уход.

Также, стоит отметить, что этот материал благодаря своим свойствам часто используется на старых автомобилях. Кузов которых с годами начинает трескаться или гнить. При правильном ламинировании этот материал, не только сможет скрыть видимую коррозию, но и продлит срок службы детали.
Кроме этого, карбон можно использоваться вместо покраски автомобиля. Зачем тратиться весь или частичный перекрас, если карбоновый пленка способна все скрыть.
С ростом использования карбона в автомобильной промышленности, он стали дешевле и популярнее, чем когда-либо прежде. В то время как в прошлом некоторые из них использовались исключительно для рынков спортивных автомобилей и суперкаров. Сейчас же он быстро становиться частью жизни многих потребительских автомобилей.
Детали автомобиля в карбоне от компании Renegade desing
Производство Renegade design предлагает огромный выбор различных аксессуаров для автомобилей. Стоит отметить, что мы заботимся о том, чтобы вы получили не только качественную деталь, но и красивую.
Этот материал является универсальным и отлично сочетается с любой маркой и любым цветом автомобиля.
Профессиональные сотрудники нашей компании имеют многолетний опыт работы с различными материалами. Поэтому, они точно знают что нужно для качественной поклейки карбона на деталь. Нам под силу даже самые безумные идеи. Команда «Renegade design» специализируется на аэродинамических тюнинг-комплектов высочайшего качества. И обратившись к нам вы точно сможете выделиться на общем фоне. Огромный выбор деталей и индивидуальный подход к каждому клиенту точно оценят все посетители нашей компании.
Карбон (материал) | это… Что такое Карбон (материал)?
Углепластик — полимерный композиционный материал из переплетенных нитей углерода, расположенных в матрице из полимерных (например, эпоксидных) смол.
Основная составляющая часть углепластика – это нити углерода (по сути, тоже самое что и, например, стержень в карандаше).
Нити углерода обычно получают термической обработкой химических или природных органических волокон, при которой в материале волокна остаются главным образом атомы углерода.
Температурная обработка состоит из нескольких этапов.
Первый из них представляет собой окисление исходного (полиакрилонитрильного, вискозного) волокна на воздухе при температуре 250 °C в течение 24 часов.
В результате окисления образуются лестничные структуры.
После окисления следует стадия карбонизации — нагрева волокна в среде азота или аргона при температурах от 800 до 1500 °C. В результате карбонизации происходит образование графитоподобных структур.
Процесс термической обработки заканчивается графитизацией при температуре 1600-3000°С, которая также проходит в инертной среде. В результате графитизации количество углерода в волокне доводится до 99 %.
Помимо обычных органических волокон (чаще всего вискозных и полиакрилонитрильных), для получения нитей углерода могут быть использованы специальные волокна из фенольных смол, лигнина, каменноугольных и нефтяных пеков.
Кроме того, детали из карбона превосходят по прочности детали из стекловолокна.
Детали из карбона обходятся значительно дороже аналогичных деталей из стекловолокна.
«Дороговизна» карбона вызвана, прежде всего, более сложной технологией производства и большей стоимостью производных материалов.
Например, для проклейки слоев используются более дорогие и качественные смолы, чем при работе со стеклотканью, а для производства деталей требуется более дорогое оборудования, к примеру, такое как автоклав.
Недостатком карбона является боязнь «точечных» ударов. Например, капот из карбона может превратиться в решето после частого попадания мелких камней. В отличие от металлических деталей или деталей из стеклоткани, восстановить первоначальный вид карбоновых деталей невозможно. Поэтому, после даже незначительного повреждения всю деталь придется менять целиком. Кроме того, детали из карбона подвержены выцветанию под воздействием солнечных лучей.
Корпус зеркала гоночного автомобиля из углепластика
Используется вместо металлов во многих изделиях, от частей космических кораблей до удочек
- ракетно-космическая техника
- авиатехника (самолетостроение, вертолетостроение)
- судостроение (корабли, спортивное судостроение)
- автомобилестроение (спортивные автомобили, мотоциклы, тюнинг и отделка)
- наука и исследования
- спортивный инвентарь (велосипеды,роликовые коньки, удочки)
- медицинская техника
- рыболовные снасти (удилища)
- телефоно- и ноутбукостроение (отделка корпусов)
что делает углерод королем стихий? – Physics World
Какой ваш любимый химический элемент? Чтобы отметить Международный год Периодической таблицы, наши научные журналисты будут спорить о том, что выбрать из 118 известных элементов. В этом выпуске Анна Демминг приводит доводы в пользу того, что углерод является фундаментальным строительным блоком жизни и химии, а также новой науки, возникшей из углеродных наноматериалов.
В этом выпуске Анна Демминг приводит доводы в пользу того, что углерод является фундаментальным строительным блоком жизни и химии, а также новой науки, возникшей из углеродных наноматериалов.
Что связывает Землю и воздух? Что и сверкает, как звездный свет, и почти ничего не отражает? Что лежит в основе химии биологических молекул — самой жизни — и положило начало целой области материаловедения в 2D, не говоря уже о ее механических, электрических и оптических свойствах, которые стоят (по крайней мере, для спонсоров) миллиарды? В той или иной форме углерод и углеродные соединения принимают участие практически во всех областях науки.
Так что же делает углерод столь вездесущим во многих областях? Химик может подумать, что неплохо начать с изучения того, как углерод связывается с другими элементами. Однако, как физик по образованию, я бы добавил, что самое интересное объясняется физикой.
Атомы углерода состоят из ядра нейтронов и шести протонов, окруженных шестью электронами. Квантовая механика диктует, что первые два электрона занимают внутреннюю атомную орбиталь, в то время как оставшиеся четыре электрона имеют волновые функции, которые лишь наполовину заполняют вторую стандартную и три вторые главные орбитали. Это оставляет каждый атом углерода жаждущим связи с другими атомами. Помимо водорода, соединений углерода больше, чем любого другого элемента, и к ним относится вся органическая химия.
Квантовая механика диктует, что первые два электрона занимают внутреннюю атомную орбиталь, в то время как оставшиеся четыре электрона имеют волновые функции, которые лишь наполовину заполняют вторую стандартную и три вторые главные орбитали. Это оставляет каждый атом углерода жаждущим связи с другими атомами. Помимо водорода, соединений углерода больше, чем любого другого элемента, и к ним относится вся органическая химия.
Самой основной органической молекулой является метан: один атом углерода связан с четырьмя атомами водорода. Тетраэдрическая форма, образованная четырьмя атомами водорода, дает каждому из внешних электронов углерода максимально возможное расстояние от других — как у некоторых братьев и сестер, которые слишком похожи, чтобы наслаждаться обществом друг друга. Отрежьте водород и соедините два вместе, и вы получите этан; добавьте еще одну метильную группу, и вы получите пропан, и так далее.
Что делает органическую химию такой плодовитой, так это возможность замены связей с атомами водорода на связи с другими атомами и молекулами, а также двойные или даже тройные связи.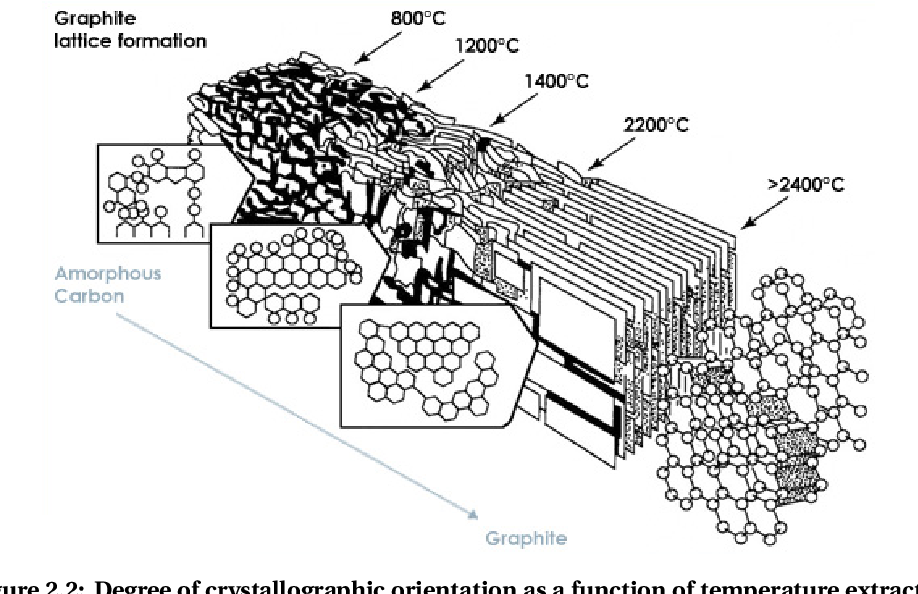 Например, замените водород кислородом, связанным с водородом с другой стороны, и вы получите спирт. Спирт этана — это этанол, содержащийся в пиве, вине и крепких спиртных напитках. (Некоторые могут возразить, что один только углерод делает его королем стихий).
Например, замените водород кислородом, связанным с водородом с другой стороны, и вы получите спирт. Спирт этана — это этанол, содержащийся в пиве, вине и крепких спиртных напитках. (Некоторые могут возразить, что один только углерод делает его королем стихий).
Если заменить ОН в этаноле на атом хлора и соединить несколько таких звеньев вместе, получится поливинилхорин (ПВХ), пример огромного раздела органической химии, полимеров. Диапазон свойств, которые могут быть достигнуты с помощью полимеров, привел к созданию целой индустрии пластмасс — материалов настолько стабильных, дешевых и универсальных, что правительства по всему миру изо всех сил пытаются не отставать от Мумбаи в регулировании их распространения и утилизации.
Углеродные цепочки также образуют кольца, как бензол – кольцо из шести атомов углерода, где каждый углерод связан с двумя другими атомами углерода с каждой стороны и водородом. Людям потребовалось некоторое время, чтобы понять, что происходит с четвертым внешним электроном, пока не была создана модель общей или «делокализованной» электронной орбитали вокруг атомов углерода кольца. (Эти делокализованные π-орбитали обнаруживаются в другой углеродной структуре, которая покорила науку о материалах.) Эти кольца и их производные — ароматические соединения, после сильного запаха бензола — еще больше обогащают библиотеку органических соединений.
(Эти делокализованные π-орбитали обнаруживаются в другой углеродной структуре, которая покорила науку о материалах.) Эти кольца и их производные — ароматические соединения, после сильного запаха бензола — еще больше обогащают библиотеку органических соединений.
Богатым источником углеводородов, которые либо используются в качестве ископаемого топлива, либо прекурсоров для других промышленных химикатов, является сырая нефть, образующаяся при разложении растений и животных, богатых углеродом, при определенных условиях глубоко в недрах Земля. При сжигании нефти и других видов ископаемого топлива выделяется углекислый газ, как и при дыхании и регулярном разложении живых животных с более умеренными темпами.
Затем растения используют CO 2 из воздуха в процессе фотосинтеза, что является частью круговорота углерода от воздуха к растениям и другим организмам, который поддерживает баланс между различными химическими веществами в атмосфере. Огромное количество CO 2 , высвобождаемый в настоящее время при сжигании ископаемого топлива, нарушает этот баланс, вызывая растущий спрос на альтернативные технологии производства и хранения энергии и энергоэффективные устройства.
Огромное количество CO 2 , высвобождаемый в настоящее время при сжигании ископаемого топлива, нарушает этот баланс, вызывая растущий спрос на альтернативные технологии производства и хранения энергии и энергоэффективные устройства.
Несмотря на всю органическую химию среди углеродных соединений, одни из самых увлекательных материаловедения – и вдохновение для технологий с приложениями от медицины и информатики до производства и хранения альтернативной энергии – это когда углерод связывается только с самим собой.
В алмазе атомы углерода связаны друг с другом в правильной тетраэдрической решетке. Эта гигантская ковалентно связанная структура делает алмаз чрезвычайно твердым и устойчивым к высоким температурам, а также к воздействию других химических веществ. Решетка также придает алмазу блеск, хотя нарушения кристаллической решетки не так уж плохи.
Я помню свое разочарование, когда прибыли образцы для некоторых моих друзей, изучающих алмазы для получения докторской степени. Это были просто маленькие коричневые квадраты без блеска из-за дефектов в кристалле, которые по-разному ослепляли исследователей. Например, дефекты азот-вакансия, когда азот заменяет атом углерода рядом с пустым узлом решетки, вызывают поведение электронного спина, которое исследователи пытались использовать в различных приложениях, от микроскопии и квантовых вычислений до биоимиджинга.
Это были просто маленькие коричневые квадраты без блеска из-за дефектов в кристалле, которые по-разному ослепляли исследователей. Например, дефекты азот-вакансия, когда азот заменяет атом углерода рядом с пустым узлом решетки, вызывают поведение электронного спина, которое исследователи пытались использовать в различных приложениях, от микроскопии и квантовых вычислений до биоимиджинга.
В отличие от алмаза, другие формы углерода являются проводящими. Еще в 17 веке люди использовали проводящую форму углерода в одном из самых распространенных инструментов для хранения данных на планете — карандаше. Графит, проходящий через карандаши, имеет многослойную структуру, и каждый слой представляет собой сотовую решетку, подобную мозаичным бензольным кольцам, где каждый атом углерода теперь связан с тремя ближайшими соседями. Как и в бензоле, образуется делокализованная π-орбиталь, позволяющая электронам проходить через структуру.
Конечно, карандаш не использует проводящие свойства графита, но он работает, потому что ковалентные связи между слоями графита слабы и достаточно небольшого трения о лист бумаги, чтобы стереть слои и записать данные в письменный след . Исследователи также использовали эти слабые межслойные связи в графитовых подложках, которые можно легко очистить, удалив верхний слой куском липкой ленты. Благодаря любопытству Андрея Гейма и Кости Новоселова в их легендарных экспериментах в пятницу вечером с этими выброшенными кусочками липкой ленты феноменальные свойства одного или нескольких слоев углерода, теперь известного как графен, занимали исследователей и спонсоров в течение многих лет. более десяти лет назад и, вероятно, будет продолжать делать это в ближайшие десятилетия.
Исследователи также использовали эти слабые межслойные связи в графитовых подложках, которые можно легко очистить, удалив верхний слой куском липкой ленты. Благодаря любопытству Андрея Гейма и Кости Новоселова в их легендарных экспериментах в пятницу вечером с этими выброшенными кусочками липкой ленты феноменальные свойства одного или нескольких слоев углерода, теперь известного как графен, занимали исследователей и спонсоров в течение многих лет. более десяти лет назад и, вероятно, будет продолжать делать это в ближайшие десятилетия.
Подробнее
Сумка пионеров графена Нобелевская премия
Еще до открытия Геймом и Новоселовым в Манчестерском университете графена в 2005 г. исследования углеродных нанотрубок, открытых в 1990 г. Сумио Иидзимой, дали представление о том, какие механические и электронные свойства проявляются в одном слое углерод. Одно из свойств графена, которое недавно взволновало исследователей, заключается в том, что свойства материалов, содержащих более одного слоя графена, могут регулироваться присутствием других двумерных материалов и даже углом или поворотом между самими слоями графена. И я готов поспорить на то, что в будущем в других формах наноуглерода можно открыть еще больше.
И я готов поспорить на то, что в будущем в других формах наноуглерода можно открыть еще больше.
Итак, мы буквально живем, едим и дышим углеродом. Он питает нашу промышленность, вдохновляет наши лаборатории и является причиной и потенциальным решением некоторых из самых серьезных проблем, стоящих перед планетой. Углерод настолько вездесущ в живых организмах, что для их датировки можно использовать радиоактивные измерения состава углерода — так что углерод тоже владеет временем. Будь то работа, отдых или игра, вы ничего не можете сделать, на что бы углерод не влиял, не регулировал и не облегчал. Нравится вам это или нет, но углерод — король стихий.
- Эта статья была отредактирована для уточнения формы молекулы метана и единиц кристаллической решетки алмаза 7 июня 2019 г.
Какой ваш любимый элемент? Свяжитесь с нами по адресу [email protected] с указанием вашего выбора и причинами – или через Twitter с хэштегом #battleofelements.
Углерод | Факты, использование и свойства
углерод
Посмотреть все СМИ
- Ключевые люди:
- Август Кекуле фон Страдониц
Сэр Гарольд В.
 Крото
Роберт Керл
Джон Ульрик Неф
Чарльз Гловер Баркла
Крото
Роберт Керл
Джон Ульрик Неф
Чарльз Гловер Баркла
- Похожие темы:
- фуллерен графен алмаз графит углерод-13
См. весь соответствующий контент →
Последние новости
5 апреля 2023 г., 13:07 по восточноевропейскому времени (AP)
Оспаривание политики Байдена в отношении «стоимости углерода» отклонено
Федеральный апелляционный суд отклонил возражение, которое Луизиана и другие республиканские штаты подали иски против экологической политики администрации Байдена
углерод (C) , неметаллический химический элемент в группе 14 (IVa) периодической таблицы. Хотя углерод широко распространен в природе, его не так много — он составляет всего около 0,025 процента земной коры, — однако он образует больше соединений, чем все остальные элементы вместе взятые. В 1961 году изотоп углерода-12 был выбран вместо кислорода в качестве эталона, относительно которого измеряется атомный вес всех других элементов. Углерод-14, который является радиоактивным, является изотопом, используемым для радиоуглеродного датирования и радиоактивной маркировки.
Углерод-14, который является радиоактивным, является изотопом, используемым для радиоуглеродного датирования и радиоактивной маркировки.
| атомный номер | 6 |
|---|---|
| атомный вес | от 12,0096 до 12,0116 |
| температура плавления | 3550 °C (6420 °F) |
| температура кипения | 4827 °C (8721 °F) |
| плотность | |
| алмаз | 3,52 г/см 3 | графит | 2,25 г/см 3 |
| аморфный | 1,9 г/см 3 |
| степени окисления | +2, +3, +4 | 9 0111
| электронная конфигурация | 1 с 2 2 с 2 2 p 2 |
Свойства и применение
По весу углерод занимает 19-е место в порядке содержания элементов в земной коре , и, по оценкам, в 3,5 раза больше углерода атомы как атомы кремния во Вселенной. Только водорода, гелия, кислорода, неона и азота атомарно больше в космосе, чем углерода. Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12,9.0005
Только водорода, гелия, кислорода, неона и азота атомарно больше в космосе, чем углерода. Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12,9.0005
Знать об углероде и почему его называют элементом жизни
Просмотреть все видео к этой статье В земной коре элементарный углерод является второстепенным компонентом. Однако соединения углерода (то есть карбонаты магния и кальция) образуют обычные минералы (например, магнезит, доломит, мрамор или известняк). Кораллы и раковины устриц и моллюсков в основном состоят из карбоната кальция. Углерод широко распространен в виде угля и органических соединений, составляющих нефть, природный газ и все ткани растений и животных. Естественная последовательность химических реакций, называемая углеродным циклом, включающая превращение атмосферного углекислого газа в углеводы путем фотосинтеза в растениях, потребление этих углеводов животными и их окисление посредством метаболизма с образованием двуокиси углерода и других продуктов, а также возврат углерода. двуокиси в атмосферу — один из важнейших биологических процессов.
двуокиси в атмосферу — один из важнейших биологических процессов.
Углерод как элемент был открыт первым человеком, который достал древесный уголь из огня. Таким образом, наряду с серой, железом, оловом, свинцом, медью, ртутью, серебром и золотом углерод был одним из небольшой группы элементов, хорошо известных в древнем мире. Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Британская викторина
Материал, из которого сделаны вещи
Элементарный углерод существует в нескольких формах, каждая из которых имеет свои физические характеристики. Две его четко определенные формы, алмаз и графит, имеют кристаллическую структуру, но различаются по физическим свойствам, поскольку расположение атомов в их структурах неодинаково. Третья форма, называемая фуллереном, состоит из множества молекул, полностью состоящих из углерода. Сфероидальные фуллерены с закрытой клеткой называются бакерминстерфуллеренами, или «бакиболами», а цилиндрические фуллерены называются нанотрубками. Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры. Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 в качестве синтетического продукта в ходе лабораторных экспериментов по моделированию химии атмосферы звезд-гигантов. Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Сфероидальные фуллерены с закрытой клеткой называются бакерминстерфуллеренами, или «бакиболами», а цилиндрические фуллерены называются нанотрубками. Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры. Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 в качестве синтетического продукта в ходе лабораторных экспериментов по моделированию химии атмосферы звезд-гигантов. Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Слово углерод , вероятно, происходит от латинского карбо , означающего по-разному «уголь», «древесный уголь», «угли». Срок бриллиант , искаженное греческое слово adamas , «непобедимый», точно описывает постоянство этой кристаллизованной формы углерода, точно так же, как графит , название другой кристаллической формы углерода, происходящее от греческого глагола графеин , «писать», отражает его свойство оставлять темный след при трении о поверхность. До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Чистый алмаз — самое твердое известное природное вещество, которое плохо проводит электричество. Графит, с другой стороны, представляет собой мягкое скользкое твердое вещество, которое является хорошим проводником как тепла, так и электричества. Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей. Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде приложений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 К (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы.
Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей. Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде приложений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 К (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы. Элементарный углерод нетоксичен.
Элементарный углерод нетоксичен.
Каждая из «аморфных» форм углерода имеет свою специфику и, следовательно, каждая из них имеет свое особое применение. Все они являются продуктами окисления и других форм разложения органических соединений. Уголь и кокс, например, широко используются в качестве топлива. Древесный уголь используется в качестве абсорбирующего и фильтрующего агента, а также в качестве топлива, а когда-то широко использовался в качестве ингредиента пороха. (Угли представляют собой элементарный углерод, смешанный с различным количеством углеродных соединений. Кокс и древесный уголь представляют собой почти чистый углерод.) Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
Углерод, элементарный или связанный, обычно определяют количественно путем преобразования в газообразный диоксид углерода, который затем может поглощаться другими химическими веществами с получением взвешиваемого продукта или раствора с кислотными свойствами, который можно титровать.
Производство элементарного углерода
До 1955 года все алмазы добывались из природных месторождений, наиболее значительных на юге Африки, но встречающихся также в Бразилии, Венесуэле, Гайане и Сибири. Единственный известный источник в США, в Арканзасе, не имеет коммерческого значения; и Индия, которая когда-то была источником чистых алмазов, в настоящее время не является важным поставщиком. Первичным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников. Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Природные месторождения разрабатывают дроблением, гравитационной и флотационной сепарацией и удалением алмазов путем прилипания их к слою смазки на подходящем столе. В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
Успешное преобразование графита в алмаз в лаборатории было осуществлено в 1955 году. Процедура включала одновременное использование чрезвычайно высокого давления и температуры с железом в качестве растворителя или катализатора. Впоследствии железо заменили хромом, марганцем, кобальтом, никелем и танталом. Синтетические алмазы в настоящее время производятся в нескольких странах и все чаще используются вместо природных материалов в качестве промышленных абразивов.



 Крото
Роберт Керл
Джон Ульрик Неф
Чарльз Гловер Баркла
Крото
Роберт Керл
Джон Ульрик Неф
Чарльз Гловер Баркла