Является основанием – Значение словосочетания ЯВЛЯЕТСЯ ОСНОВАНИЕМ. Что такое ЯВЛЯЕТСЯ ОСНОВАНИЕМ?
Синонимы к словосочетанию ЯВЛЯЕТСЯ ОСНОВАНИЕМ
ЯВЛЯ́ТЬСЯ, —я́юсь, —я́ешься; несов. 1. Несов. к явиться.
Все значения слова «являться»ОСНОВА́НИЕ, -я, ср. 1. Действие по знач. глаг. основать. Основание города.
Все значения слова «основание»-
По действующему арбитражному процессуальному законодательству заключение соглашения о передаче спора на разрешение третейского суда не рассматривается как отказ от права на обращение в арбитражный суд и не является основанием для отказа или возвращения искового заявления.
-
Вместе с тем принятие решения по результатам рассмотрения дела в пользу истца не является основанием для отнесения указанных расходов на ответчика, если в удовлетворении заявления об обеспечении иска было отказано, поскольку в данном случае соответствующее требование о принятии обеспечительных мер истцом было заявлено при отсутствии должных оснований.
-
Объявление на взнос наличными является основанием на внесение наличных денежных средств на текущий счёт из кассы.
ЯВЛЯЕТСЯ ОСНОВАНИЕМ — разбор слова по составу (морфемный разбор)
ЯВЛЯ́ТЬСЯ, —я́юсь, —я́ешься; несов. 1. Несов. к явиться. Все значения слова «являться»ОСНОВА́НИЕ, -я, ср. 1. Действие по знач. глаг. основать. Основание города.
Все значения слова «основание»-
По действующему арбитражному процессуальному законодательству заключение соглашения о передаче спора на разрешение третейского суда не рассматривается как отказ от права на обращение в арбитражный суд и не является основанием для отказа или возвращения искового заявления.
-
Вместе с тем принятие решения по результатам рассмотрения дела в пользу истца не является основанием для отнесения указанных расходов на ответчика, если в удовлетворении заявления об обеспечении иска было отказано, поскольку в данном случае соответствующее требование о принятии обеспечительных мер истцом было заявлено при отсутствии должных оснований.
-
Объявление на взнос наличными является основанием на внесение наличных денежных средств на текущий счёт из кассы.
Основание (химия) — Википедия
У этого термина существуют и другие значения, см. Основание. Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда ) либо с вакантной орбиталью другого химического соединения (основание Льюиса
) либо с вакантной орбиталью другого химического соединения (основание Льюиса )[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].Частным случаем оснований являются щёлочи — гидроксиды щелочных, щелочноземельных металлов, а также некоторых других элементов, например, таллия. Реакции оснований с кислотами называют реакциями нейтрализации.
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме[3].
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−[4]. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам [5].
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя[4].
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури[править | править код]
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты[6]. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием
B+h3O⇌BH++OH−.{\displaystyle {\mathsf {B+H_{2}O}}\rightleftharpoons {\mathsf {BH^{+}+OH^{-}}}.}
Основание в теории Льюиса[править | править код]
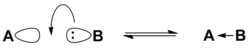
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса[7]. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями[8]. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях[4].
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания[8][4].
AlCl3+Cl−⇌AlCl4−{\displaystyle {\mathsf {AlCl_{3}+Cl^{-}}}\rightleftharpoons {\mathsf {AlCl_{4}^{-}}}}
BF3+(C2H5)2O⇌BF3⋅(C2H5)2O{\displaystyle {\mathsf {BF_{3}+(C_{2}H_{5})_{2}O}}\rightleftharpoons {\mathsf {BF_{3}\cdot (C_{2}H_{5})_{2}O}}}
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью[9][10]. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью[10]. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами[11].
| Жёсткие основания | Промежуточные основания | Мягкие основания |
|---|---|---|
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. Например, мягкость оснований убывает в следующих рядах[8]:
I−>Br−>Cl−>F−,{\displaystyle {\mathsf {I^{-}>Br^{-}>Cl^{-}>F^{-}}},}
Ch4−>Nh3−>OH−>F−.{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-}}}.}
Основание в общей теории Усановича[править | править код]
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители[5]. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции[13].
Количественное описание силы оснований[править | править код]
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон[8]. Часто константу основности выражают в виде показателя константы основности pKb. Например, для аммиака как основания Брёнстеда можно записать[4][14]:
Nh4+h3O⇌Nh5++OH−{\displaystyle {\mathsf {NH_{3}+H_{2}O}}\rightleftharpoons {\mathsf {NH_{4}^{+}+OH^{-}}}}
Kb=[Nh5+]⋅[OH−][Nh4]=1,79⋅10−5;{\displaystyle K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{-5};}
pKb=−logKa=4,75.{\displaystyle \ \mathrm {p} K_{b}=-\log K_{a}=4{,}75.}
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
PO43−+h3O⇌HPO42−+OH−;Kb1=[HPO42−]⋅[OH−][PO43−]=2,10⋅10−2;{\displaystyle {\mathsf {PO_{4}^{3-}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{2-}+OH^{-}}};K_{\mathrm {b1} }={\frac {[{\mathsf {HPO_{4}^{2-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {PO_{4}^{3-}}}]}}=2{,}10\cdot 10^{-2};}
HPO42−+h3O⇌h3PO4−+OH−;Kb2=[h3PO4−]⋅[OH−][HPO42−]=1,58⋅10−7;{\displaystyle {\mathsf {HPO_{4}^{2-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{\mathrm {b2} }={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {HPO_{4}^{2-}}}]}}=1{,}58\cdot 10^{-7};}
h3PO4−+h3O⇌h4PO4+OH−;Kb3=[h4PO4]⋅[OH−][h3PO4−]=1,32⋅10−12.{\displaystyle {\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{3}PO_{4}+OH^{-}}};K_{\mathrm {b3} }={\frac {[{\mathsf {H_{3}PO_{4}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32\cdot 10^{-12}.}
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов[14] и константе автопротолиза растворителя в общем случае[8].
Ka(Nh5+)=[Nh4]⋅[H+][Nh5+]=5,62⋅10−10;{\displaystyle K_{a}\mathrm {(NH_{4}^{+})} ={\frac {[{\mathsf {NH_{3}}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {NH_{4}^{+}}}]}}=5{,}62\cdot 10^{-10};}
Ka(Nh5+)⋅Kb(Nh4)=Kw=1⋅10−14;{\displaystyle {K_{a}\mathrm {(NH_{4}^{+})} }\cdot {K_{b}\mathrm {(NH_{3})} }=K_{w}=1\cdot 10^{-14};}
pKa(Nh5+)+pKb(Nh4)=pKw=14{\displaystyle {\mathrm {p} K_{a}\mathrm {(NH_{4}^{+})} }+{\mathrm {p} K_{b}\mathrm {(NH_{3})} }=\mathrm {p} K_{w}=14}
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−[8].
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах[4]| Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) | Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) |
|---|---|---|---|---|---|---|---|
| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Влияние растворителя[править | править код]
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH−, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14[15][16].
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных оснований для них разный[17].
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большинство известных оснований по силе со своим сопряжённым основанием — ацетат-ионом CH3COO−. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований[18].
Влияние строения основания[править | править код]
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак[19]. Напротив, введение акцепторных заместителей в молекулу понижает силу основания[8].
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания соответственно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Данный эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы[20].
- Эффект сопряжения проявляется также в том случае, если электронная пара основания находится в системе сопряжения, например, с ароматической системой или двойной связью. В таком случае основания имеют более низкую силу. Например, амиды и анилины являются гораздо более слабыми основаниями, чем амины[19].
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона[20].
Ch4−>Nh3−>OH−>F−;{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-};}}}
Nh4>Ph4>Ash4{\displaystyle {\mathsf {NH_{3}>PH_{3}>AsH_{3}}}}
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2— и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной[19].
RCh3Nh3>RCH=NH>RC≡N{\displaystyle {\mathsf {RCH_{2}NH_{2}>RCH{=}NH>{RC}{\equiv }{N}}}}
Супероснования[править | править код]
- ↑ 1 2 С одной стороны, наличие третьей алкильной группы в триметиламине и триэтиламине должно увеличивать их основность. С другой стороны, с добавлением третьего заместителя резко уменьшается способность сопряжённых кислот (CH3)3NH+ и (C2H5)3NH+ к гидратации, что уменьшает их устойчивость и суммарно понижает основность аминов.
- ↑ IUPAC Gold Book — base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. Органическая химия. 9 класс. — 13-е изд. — М.: Просвещение, 2009. — С. 10. — ISBN 978-5-09-021-625-8.
- ↑ William B. Jensen, The Origin of the Term Base, Journal of Chemical Éducation • 1130 Vol. 83 No. 8 août 2006
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395. — ISBN 5-85270-039-8.
- ↑ 1 2 Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М: Высшая школа, 1999. — С. 118. — ISBN 5-06-003558-1.
- ↑ IUPAC Gold Book — Brønsted base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ IUPAC Gold Book — Lewis base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 3 4 5 6 7 8 Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- ↑ IUPAC Gold Book — hard base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 Химическая энциклопедия, 1992, т. 2, с. 145.
- ↑ IUPAC Gold Book — hard acid (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Золотов и др., 1999, с. 152.
- ↑ Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 40—44.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978. — С. 232—236.
- ↑ Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд. — М: Бином. Лаборатория знаний, 2010. — Т. 1. — С. 40. — ISBN 978-5-94774-614-9.
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М: Академия, 2004. — Т. 1. — С. 89—94. — ISBN 5-7695-1446-9.
- ↑ Золотов и др., 1999, с. 123—125.
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ: Издательство ВСГТУ, 2005. — С. 8—14. — ISBN 5-89230-037-4.
- ↑ 1 2 3 4 Сайкс П. Механизмы реакций в органической химии = A Guidebook to Mechanism in Organic Chemistry / Под ред. Я. М. Варшавского. — 3-е изд.. — М: Химия, 1977. — С. 82—91.
- ↑ 1 2 Марч Дж. Органическая химия. Реакции, механизмы и структура. Т. 1 / Пер. с англ. З. Е. Самойловой, под ред. И. П. Белецкой. — М: Мир, 1987. — С. 340—346.
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Поделиться ссылкой:
являвшийся основанием — это… Что такое являвшийся основанием?
- являвшийся основанием
- являвшийся основанием
прил., кол-во синонимов: 2
Словарь синонимов ASIS. В.Н. Тришин. 2013.
.
- являвшийся игрушкой в руках
- копивший деньги
Смотреть что такое «являвшийся основанием» в других словарях:
являвшийся заслугой — прил., кол во синонимов: 2 • был основанием для уважения (2) • делавший честь (2) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
был основанием для уважения — прил., кол во синонимов: 2 • делавший честь (2) • являвшийся заслугой (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
обуславливавший — прил., кол во синонимов: 42 • будивший (52) • влекший (56) • влекший за собой (42) … Словарь синонимов
обусловливавший — прил., кол во синонимов: 45 • будивший (52) • был обусловленным (2) • влекший (56) … Словарь синонимов
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Великобритания — I Содержание: А. Географический очерк: Положение и границы Устройство поверхности Орошение Климат и естественные произведения Пространство и население Эмиграция Сельское хозяйство Скотоводство Рыбная ловля Горный промысел Промышленность Торговля… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Власть — (Authority) Определение власти, природа власти, структура политической власти Информация об определении власти, природа власти, структура политической власти Содержание Содержание: Природа политической . Власть как общественное явление как… … Энциклопедия инвестора
Ростопчин, граф Феодор Васильевич — — обер камергер, Главнокомандующий Москвы в 1812—1814 гг., член Государственного Совета. Род Ростопчиных родоначальником своим считает прямого потомка великого монгольского завоевателя Чингисхана — Бориса Давидовича Ростопчу,… … Большая биографическая энциклопедия
ИСТОРИОГРАФИЯ — (от история (см.) и греч. grapo пишу, букв. описание истории) 1) История ист. науки, являющейся одной из важнейших форм самопознания человеческого общества. И. наз. также совокупность исследований, посвященных определенной теме или исторической… … Советская историческая энциклопедия
Феодализм — Содержание [О Ф. во Франции см. соотв. ст.]. I. Сущность Ф. и его происхождение. II. Ф. в Италии. III. Ф. в Германии. IV. Ф. в Англии. V. Ф. на Пиренейском полуострове. VI. Ф. в Чехии и Моравии. VII. Ф. в Польше. VIII. Ф. в России. IX. Ф. в… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Предложения со словосочетанием ЯВЛЯЕТСЯ ОСНОВАНИЕМ
По действующему арбитражному процессуальному законодательству заключение соглашения о передаче спора на разрешение третейского суда не рассматривается как отказ от права на обращение в арбитражный суд и не является основанием для отказа или возвращения искового заявления. Вместе с тем принятие решения по результатам рассмотрения дела в пользу истца не является основанием для отнесения указанных расходов на ответчика, если в удовлетворении заявления об обеспечении иска было отказано, поскольку в данном случае соответствующее требование о принятии обеспечительных мер истцом было заявлено при отсутствии должных оснований. Объявление на взнос наличными
 Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Вопрос: иконопись — это что-то нейтральное, положительное или отрицательное?
Положительное
Отрицательное
Экологические правонарушения являются основанием для наступления эколого-правовой ответственности. Вторая группа: насколько прочнымОснование (химия) — это… Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение


Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.
- Летучие: NH3, CH3-NH2
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
- Tl2O3•n H2O — полигидрат оксида таллия(III)
- MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
- Примечание: реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Основания вступают в обменные реакции (реагируют с растворами солей):
- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9

