Приора устройство эур: Устройство электроусилителя руля приора | Хитрости Жизни
Ремонт ЭУР на Лада Приора. Снятие, установка и основные поломки
Давно прошли те времена, когда управление автомобилем напоминало комплекс силовых упражнений для рук. Сегодня для того, чтобы повернуть руль, достаточно легкого касания ладонью, и все за счет использования электроусилителя руля. Конечно же, это устройство усложняет конструкцию, а чем сложнее устроена любая, не только техническая система, тем в большей степени она подвержена сбоям и поломкам.
Каждая Лада Приора оснащается электроусилителем руля (ЭУР), и сегодня мы расскажем, как диагностировать возникшие с ним проблемы и провести его демонтаж без обращения в автосервис.
Оглавление:
1 Проблемы с ЭУР Лада Приоры: признаки и причины
1.1 ЭУР отказал полностью
1.2 Нестабильная работа руля
1.3 Стук в руле
2 Снятие и установка ЭУР
2.1 Как снять руль?
2.2 Крышка монтажного блока и подрулевые переключатели
2.2 Процесс изъятия электроусилителя
3 Механические поломки ЭУР
4 Как сохранить подольше ЭУР в рабочем состоянии?
Проблемы с ЭУР Лада Приоры: признаки и причины
Предыдущие ВАЗовские модели снабжались гидроусилителем руля, который менее надежен, чем ЭУР. Тем не менее, электрический аналог этого устройства также подвержен возникновению неисправностей, которые нужно своевременно выявлять, иначе безопасность вождения будет под угрозой, не говоря уже о комфорте.
Тем не менее, электрический аналог этого устройства также подвержен возникновению неисправностей, которые нужно своевременно выявлять, иначе безопасность вождения будет под угрозой, не говоря уже о комфорте.
Во всех случаях, начиная движение, обращаем внимание на значок в виде руля с восклицательным знаком, который всякий раз вспыхивает на приборной доске, как только мы поворачиваем ключ зажигания. Если значок не гаснет, то это верный признак неполадки с усилителем.
ЭУР отказал полностью на Приоре
Бортовой компьютер при отказе ЭУР должен (как нам хотелось бы) высветить код неисправности устройства, которая привела к его отключению (коды ошибок, связанных с ЭУР, начинаются с литеры «С»).
Однако в некоторых случаях убедиться в отключении ЭУР можно лишь эмпирическим путем. Самый простой способ – это при выключенном двигателе попробовать покрутить руль. Затем двигатель включается, и снова проводится вращение руля. Если по ощущениям в обоих случаях требуется одинаковое физическое усилие, то с большой долей вероятности ЭУР отключился. Дальнейшее движение возможно только к месту проведения ремонта.
Дальнейшее движение возможно только к месту проведения ремонта.
Случается, что отказ ЭУР и спидометра происходят одновременно. Вышедший из строя датчик скорости не дает сигнала системе, которая управляет усилителем руля исходя из показателей скорости. При этом проблема может крыться в повреждении проводки, соединяющей спидометр, датчик скорости и ЭУР. Если с ней все в порядке, то следует заменить датчик скорости.
- загрязненные или пригоревшие контакты, нагар или окалина, препятствующие полноценной электропроводности;
- повреждения изоляции проводки;
- сбой в настойках блока питания;
- слабый заряд аккумулятора.
Если усилителю не хватает напряжения, то компьютерная диагностика покажет ошибку С1013. Для полноценной работы рулевого усилителя Приоры ему требуется минимум 13,5 В напряжения. Поэтому первичную диагностику проблем с напряжением следует повести таким образом:
- замерять напряжение на аккумуляторе.
 Возможно, его нужно просто зарядить;
Возможно, его нужно просто зарядить; - если с АКБ все в порядке, то проверяется изоляция проводки и контактов на предмет короткого замыкания.
Диагностировать повреждение проводов и контактов может автоэлектрик.
Нестабильная работа руля
Случается, что во время езды по ровной дороге руль ни с того ни сего заваливается в сторону. И такой вариант намного опаснее, чем полный отказ ЭУР. В последнем случае машина слушается, и можно по крайней мере добраться до СТО, в то время как при непредсказуемой работе усилителя в любой момент можно вылететь с трассы или выехать на встречку.
В таких случаях требуется полностью отключить усилитель, вытащив соответствующий предохранитель (F5) из монтажного блока салона. Как до него добраться, стоит почитать в отдельной статье. Сразу скажем, что проблема может крыться далеко и не только предохранителе, и чтобы понять, что на самом деле является причиной такой работы ЭУР, диагностику придется выполнить только на СТО, т. к. самостоятельно это сделать очень непросто.
к. самостоятельно это сделать очень непросто.
Стук в руле на приоре
Чаще всего стук появляется из-за повреждений механической части рулевой системы (вала, рулевых реек и тяг, шаровых опор и т.д.). А вот на автомобилях Лада Калина и Гранта стук может быть связан с люфтом редукторного ЭУР, причем произведенного в Махачкале. Однако, если стук чувствуется и слышится на Приоре, то причину в ее рулевом усилителе нужно искать в последнюю очередь, поскольку автомобили ВАЗ 2170 редукторными, и тем более махачкалинскими ЭУР не комплектуются. А значит, обратить внимание надо на механическую часть ЭУР – вал, соединительные элементы, арматуру и другие детали, но уже после проверки остальных систем.
В случае же механических повреждений ЭУР, бортовой компьютер может вообще не показывать ошибок, из-за чего приходится производить демонтаж и даже разборку усилителя.
Снятие и установка ЭУР
Чтобы оценить состояние механической части ЭУР или его контактов, требуется полностью извлечь его наружу.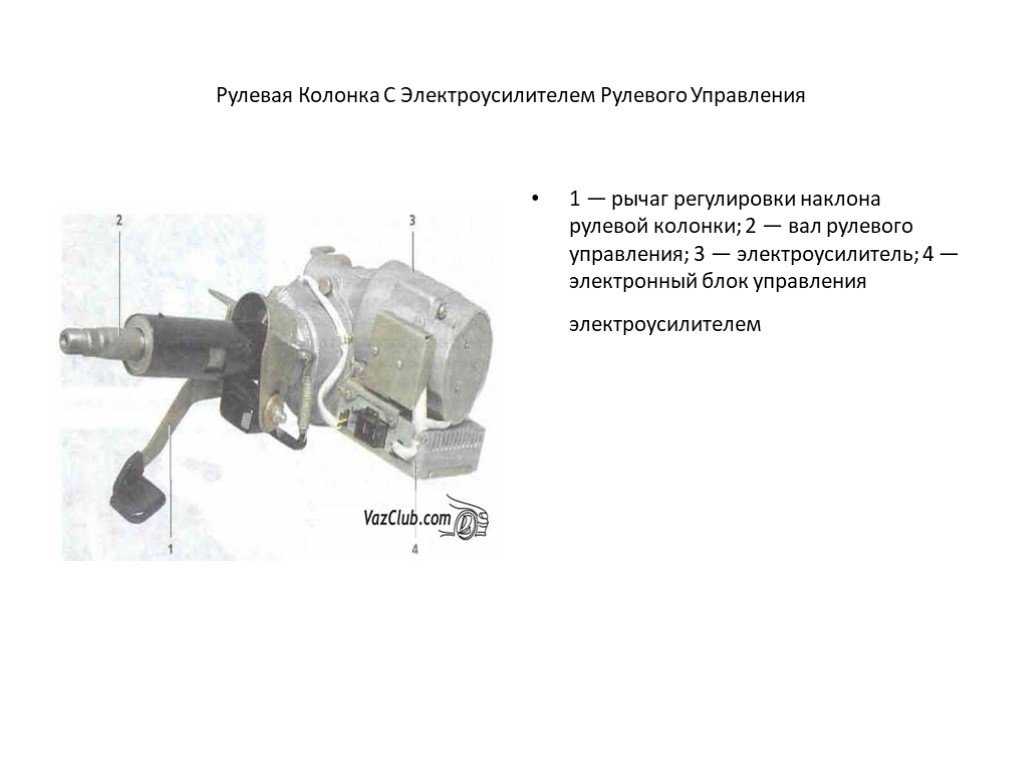 При этом собственно усилитель вытащить нетрудно, трудно получить к нему доступ. Для этого придется демонтировать руль, рулевой кожух и замок зажигания, крышку монтажного блока и целый ряд прочих узлов, интерфейс которых выведен на руль.
При этом собственно усилитель вытащить нетрудно, трудно получить к нему доступ. Для этого придется демонтировать руль, рулевой кожух и замок зажигания, крышку монтажного блока и целый ряд прочих узлов, интерфейс которых выведен на руль.
Обо всем этот по порядку.
Как снять руль на Лада Приора?
Для того, чтобы снять руль, нужно приготовить:
- торцовый ключ на 24 мм.;
- 5-мм. шестигранный ключ;
- плоскую и крестовую отвертки;
- молоток;
- зубило.
Кроме того, нужно обесточить автомобиль, отключив аккумулятор. Вообще этот пункт является обязательным при выполнении любых ремонтных работ. Дальнейший алгоритм представляет собой такую последовательность действий:
- руль выставляется прямо;
- крестовой отверткой выкручиваем 7 шурупов, удерживающих кожух руля;
- находим замок зажигания и ищем его провода, где он соединяется с другими. Рассоединяем их;
- теперь предстоит снять замок зажигания, отвинтив четыре крепко закрученных болта.
 Для этого с помощью молотка и зубила наносят косые удары по головке каждого болта против часовой стрелки, как бы пытаясь их открутить. Может даже не получиться, поэтому часто приходится пользоваться дрелью, чтобы их высверлить. Вообще, болты эти повторно не используются, и щадить их не нужно, т.к. при каждой установке замка применяют новые болты;
Для этого с помощью молотка и зубила наносят косые удары по головке каждого болта против часовой стрелки, как бы пытаясь их открутить. Может даже не получиться, поэтому часто приходится пользоваться дрелью, чтобы их высверлить. Вообще, болты эти повторно не используются, и щадить их не нужно, т.к. при каждой установке замка применяют новые болты; - когда все 4 болта откручены, замок зажигания можно снять;
- с помощью 6-гранного ключа откручиваются 2 крепления подушки безопасности на руле, после чего саму подушку нужно немного провернуть;
- подушка отсоединяется от руля, если ее потянуть на себя и одновременно поддеть снизу плоской отверткой, однако тащить ее сразу нельзя: чтобы убрать ее в сторону, нужно поддеть и отвести фиксатор колодки проводов, которыми подушка сообщается с рулем;
- когда колодка проводов снята, подушку убираем в сторону;
- далее плоской отверткой отсоединяем колодку проводов, идущих на сигнал;
- теперь открылось крепление руля к валу.
 С помощью цветного маркера или другого обозначения, отмечаем положение рулевого колеса на валу, которое соответствует его прямой ориентации;
С помощью цветного маркера или другого обозначения, отмечаем положение рулевого колеса на валу, которое соответствует его прямой ориентации; - при помощи торцового ключа на 24 отдаем гайку, которой руль крепится на валу. При этом придется приложить силу, т.к. эта гайка затянута надежно;
- далее снимаем с вала руль, резко расшатывая или подбивая его из стороны в сторону, и после потягивая на себя.
Как видите, ничего сложного нет, кроме того, что требуются определенные физические усилия и грубые методы. Теперь дело за крышкой монтажного блока и подрулевыми переключателями.
Крышка монтажного блока и подрулевые переключатели
Вообще, релейно-предохранительных блоков на приоре три плюс один чисто предохранительный. Нас интересует крышка монтажного блока в салоне, который находится напротив левой ноги водителя.
Три замка крышки этого блока поворачиваются, в результате чего высвобождается нижняя часть крышки. Под ней мы находим рулевые переключатели, с помощью которых происходит указание поворотов, управление стеклоочистителями и связь с бортовым компьютером. Отключаются они следующим образом:
Отключаются они следующим образом:
- Пластиковые фиксаторы каждого (левого и правого) переключателя сжимаются;
- При сжатых фиксаторах каждый переключатель вынимается из гнезда;
- Выворачиваем 4 винта крепления усилителя приборной панели и снимаем этот усилитель.
- Отсоединяем колодку жгута проводов от катушки иммобилайзера.
Теперь остается заняться непосредственно усилителем руля.
Процесс изъятия электроусилителя
Для того, чтобы заняться непосредственно ЭУР, понадобятся головки на 8 и 13 мм., трещотка или вороток. Далее действуем следующим образом:
- С помощью 8-мм головки и трещотки отворачиваем контактную колодку и снимаем ее с вала;
- Отсоединяем все провода, ведущие к блоку управления ЭУР, обращая внимание на принцип работы проводных фиксаторов. Если с ним не разобраться, то фиксаторы можно повредить настолько, что потребуется замена этого элемента проводки;
- Находим карданный шарнир электроусилителя руля и головку стяжного болта на нем.
 Выкручиваем болт головкой на 13;
Выкручиваем болт головкой на 13; - С помощью молотка и зубила чуть расширяем стяжной хомут карданного соединения;
- Откручиваем 2 верхние гайки, которыми усилитель руля крепится к кузову;
- 2 нижние гайки не нужно откручивать полностью, достаточно провернуть их на 4 оборота, придерживая при этом ЭУР;
- После всего ЭУР можно, наконец, вынуть из кузова, сдернув с вала рулевой рейки.
Теперь у нас есть возможность полностью разобрать усилитель, произвести визуальную диагностику на предмет поломок, почистить и поставить обратно.
Установка отремонтированного или нового рулевого электроусилителя происходит в обратной последовательности. Перед этим важно проверить правильность расположения специальных пометок на защитном чехле, валу и крышке картера.
Конечно же, одно лишь снятие ЭУР не всегда дает возможность найти причину его неисправности, поскольку она может крыться в электротехнической части этого узла. В последнем случае понадобится тонкая диагностика на СТО, которую в гаражных условиях рядовой автомобилист вряд ли способен произвести.
Механические поломки ЭУР
Для чего, собственно, мы сняли ЭУР? Диагностика электротехнической части устройства не выявила проблем, а значит, нужно искать причину нарушений его работы в механике, которая может быть такой:
- Износ или засорение элементов привода или червячного механизма;
- Износ опорного подшипника червячного вала электропривода ЭУР;
- Другие признаки, указывающие на разрушение или износ деталей ЭУР.
В таких случаях требуется заменить изношенную деталь, по возможности попытавшись разобраться с факторами, повлиявшими на такой результат работы усилителя, или, в критическом случае – купить новый электроусилитель.
Как сохранить подольше ЭУР в рабочем состоянии?
Несмотря на то, что самостоятельно снять ЭУР можно и в гаражных условиях, без специальных инструментов и особых навыков, процедура эта небыстрая, т.к. к данному устройству быстро подобраться не получится. Поэтому автомобилистов интересует простой вопрос – как избежать необходимости ремонтировать или менять ЭУР.
Для этого придется придерживаться таких правил:
- Никогда не трогаться с места, если руль находится в одном и крайних положениях. Надолго оставлять руль в таком положении тоже не рекомендуется даже без движения;
- Не удерживать руль дольше 4-5 секунд в крайних положениях, даже если того требует парковка или разворот. Лучше совершать нужные маневры;
- Обращать внимание на звуки, доносящиеся из электроусилителя;
- Прочищать контакты и подвижные механизмы от загрязнений;
- Обращать внимание на состояние проводки и клемм, если они попадаются на глаза в случае проверки других технических систем;
- Почаще проводить диагностику этого узла.
Устройство и принцип работы электроусилителя руля на Ладе Приора
Содержание
- Электроусилитель руля
- Устройство ЭУР
- Способы определения неисправности ЭУР
- «Народный» способ проверки неисправности, или «контроль»
- Какие всё-таки неисправности существуют в электроусилителе «Приоры»
- Снятие и установка
Автомобиль нашего времени кардинально отличается от машин прошлого века. Это касается всех аспектов. И одним из главнейших признаков нового автомобиля стала лёгкость вращения рулевого колеса. Теперь даже находясь в стоящем на одном месте автомобиле, водитель может крутить руль двумя пальцами. Чем же достигается такой эффект? Это работа электрического усилителя руля (ЭУР). Но иногда он выходит из строя.
Это касается всех аспектов. И одним из главнейших признаков нового автомобиля стала лёгкость вращения рулевого колеса. Теперь даже находясь в стоящем на одном месте автомобиле, водитель может крутить руль двумя пальцами. Чем же достигается такой эффект? Это работа электрического усилителя руля (ЭУР). Но иногда он выходит из строя.
Электроусилитель руля
Этот аппарат делает мощнее усилие, которое передаётся в системе рулевого управления. Проще говоря, руль можно крутить двумя пальцами. Ранее на моделях ВАЗ ставились гидравлические усилители (ГУР), но начиная с Лады «Калины» от них отказались.
По мощности передачи усилия ГУР предпочтительнее, однако, у него много недостатков:
- Отбор мощности у двигателя.
- Необходим постоянный контроль за уровнем в бачке.
- Проверка маслопроводов.
Всех этих недостатков электроусилитель лишён. И он даже более прост в ремонте, чем ГУР. Но и своих неисправностей у него хватает.
Устройство ЭУР
Основные составляющие электрического усилителя:
- Механическая часть.
- Электрическая составляющая.
- Электронный блок управления (ЭБУ) с периферией.
В механическую часть входят, собственно детали рулевого управления, соединительные части и крепёжная арматура. То есть входной и выходной валы, кронштейн, гайки, болты, шпильки и пружины. Ну ещё регулировочный рычаг, для изменения угла наклона руля.
Электрическая, собственно сам мотор усилителя. Наиболее уязвима электронная составляющая. ЭБУ и разъёмы с датчиками.
Способы определения неисправности ЭУР
Ну конечно, первейший признак поломки в системе — это срабатывание сигнальной лампочки ЭБУ на панели приборов. Обычно на стандартной заводской модели «Приоры», это значок в форме рулевого колеса с восклицательным знаком. При включении зажигания, он на несколько секунд загорается, а потом, если компьютер решил что всё в порядке, лампочка гаснет. И соответственно, когда обнаружена поломка электроусилителя «Приоры» — загорается и остаётся гореть.
И соответственно, когда обнаружена поломка электроусилителя «Приоры» — загорается и остаётся гореть.
Итак, провести компьютерную диагностику, связаться с ЭБУ получить коды ошибок с расшифровкой или без. Даже если сканер выдаёт только коды, это не страшно. Можно просто знать, что неисправности связанные с ЭУР «Приоры», начинаются с символа «С». Например, С1013, обозначает что низкое напряжение в сети, и электроусилителю этого мало.
Ну тут могут быть несколько вариантов. Самый распространённый случай, это ослабление, или пригорание одного из двух силовых проводов, идущих на ЭУР. Это красный и чёрный провода, большого сечения, входящие в отдельный разъём на устройстве. Их довольно просто проверить. А также это может быть большой предохранитель на устройство, тут всё понятно. Ну а третья причина, это недостаток в сети автомобиля, например, слабые, или неисправные, аккумулятор или генератор. При такой неисправности к специалисту, и никак иначе. К автоэлектрику.
«Народный» способ проверки неисправности, или «контроль»
Ну а если сигнализатор не горит, а сомнения в исправности или неисправностей ЭУР «Приоры» присутствуют, или после проведения ремонта нужно сделать «контроль», поступают следующим образом: нужно не включая зажигания покрутить рулевое колесо. Запомнить усилие. И повторить операцию запустив мотор. Если изменений нет, с ЭУР «Приоры» что-то произошло!
Какие всё-таки неисправности существуют в электроусилителе «Приоры»
И снова тот же список, механика, электрика, электроника. Ну с механикой всё понятно, это выход из строя валов, соединений и арматуры. При этой неисправности, колёса просто не отреагируют на поворот баранки. И эту неисправность, проще всего устранить. А вот с остальными неисправностями гораздо сложней. Если неисправности связаны с выходом из строя самого сервомотора, усилителя, «Приоры» о ремонте не стоит и думать.
Проще приобрести в магазине новый ЭУР и самостоятельно заменить.
Либо отнести на сервис, и попытаться отремонтировать там. Если пропала связь с ЭБУ ЭУР «Приоры», то это, скорее всего, второй разъём, со шлейфом проводов, то же и в случае неполучения сигнала для блока, от внешних датчиков — коленчатого вала и распредвала. Да, да они также важны для работы устройства. В этих случаях можно снять и отремонтировать, или заменить недорогой пучок проводов.
Остался сам «мозг» электроусилителя, и внутренние датчики положения валов агрегата. С датчиками возиться не вариант, только ремонтный сервис. А вот сам компьютер, при его неисправности, можно купить и заменить самостоятельно.
Снятие и установка
Это не такая уж и сложная процедура, как может показаться. И даже требует очень мало инструмента:
- Накидной ключик на 8.
- Головка с воротком, или торцевой ключ на 13.
- Фигурная (крестовая) отвёртка.
И более ничего, кроме умения, ими пользоваться. Это при условии, что сам руль уже снят, а это отдельная история.
Ну а теперь вперёд. Пластмассовые накладки с колонки руля снять, вывернув 2 самореза и отстегнув 2 фиксатора. Отвёрткой же, выкручиваем болты, в количестве четырёх штук, и отделяем нижнюю часть накладки. Теперь мешают замок, и «вертолёт» — переключатели поворотов и дворников. Первым делом, прижимая на разъёмах усики, отключаем все провода. Потом, ключом на 8, ослабить хомут, который прикрепляет эти устройства, после чего, они свободно сойдут с кожуха вала.
Отсоединить два разъёма от ЭБУ ЭУР. Снять со специальной шпильки пластиковую накладку.
Нижние гайки не откручивать совсем, а провернуть на несколько оборотов ключом № 13. А вот стяжной болт шарниров промежуточного вала, вытащить полностью, открутив его гайку на 13. Ну вот.
Выкрутив все крепёжные гайки, можно вытаскивать неисправный ЭУР «Приоры». Ключом на 13 освободить нижний вал устройства от шлицевого шарнира. Ну вот и всё. Можно попытаться починить описанные выше неисправности самому, отнести в мастерскую или просто поставить новый агрегат на свою «Приору», действуя в обратном порядке.
Полезное видео по общему ремонту электроусилителя руля «Приоры»:
неисправности и ремонт ЭУР Приора
Электроусилитель руля (ЭУР) является более современной альтернативой традиционной системе ГУР. С одной стороны, электроусилитель действительно имеет ряд определенных преимуществ, однако система все равно не лишена недостатков. Более того, на бюджетных автомобилях (в том числе и на Лада Приора) неисправности ЭУР могут проявляться даже на небольших пробегах.
В подобной ситуации важно знать, какие признаки указывают на то, что электроусилитель Приора нуждается в диагностике, а также какие неисправности могут возникать, как определить и устранить поломку. Далее мы рассмотрим, какие поломки характерны для ЭУР Приоры, а также как выполняется ремонт электроусилителя руля Lada Priora.
Содержание статьи
- Электроусилитель рулевого управления Лада Приора: устройство ЭУР и принцип работы
- Диагностика неисправности ЭУР
- Частые неисправности электроусилителя руля и ремонт
- Как заменить электроусилитель руля на Приоре
- Подведем итоги
Электроусилитель рулевого управления Лада Приора: устройство ЭУР и принцип работы
Итак, электроусилитель руля обеспечивает необходимую легкость во время вращения рулевого колеса на месте или в движении. Механизм создает усилие, которое передастся на систему рулевого управления.
При этом в отличие от ГУР, усилитель ЭУР не отнимает мощность двигателя, не нуждается в сложной схеме нагнетания под высоким давлением гидравлической жидкости, меньше шумит, не течет и теоретически должен быть более надежным.
По этой причине сначала ВАЗ ставил на некоторые модели ГУР, но затем начали ставить электроусилитель руля на Приору, Калину и т.д. Однако на деле ЭУР также не лишен недостатков, данный узел ломается, причем в ряде случаев чаще и раньше, чем ГУР.
Начнем с устройства ЭУР. Основные составные элементы электрического усилителя руля можно поделить на три группы:
- механика;
- электрика;
- управляющая электроника;
Механика фактически представляет собой элементы рулевого управления (например, входной и выходной вал и т.д.). Электрика предполагает электрический мотор усилителя, выводы, клеммы, контакты. Электроника включает в себя блок управления ЭУР (ЭБУ ЭУР), группу датчиков ЭУР, разъемы. В совокупности, рулевая рейка Приора с ЭУР выполнена так, чтобы электрический мотор мог создавать усилие. При этом самой «слабой» частью считается именно электроника, а не механическая часть.
Что касается принципа работы ЭУР, он достаточно прост. Когда водитель поворачивает рулевое колесо, датчики фиксируют поворот рулевого вала, после чего подключается электромотор, который и создает необходимое дополнительное усилие. Казалось бы, решение простое и надежное, однако это не совсем так.
Диагностика неисправности ЭУР
Прежде всего, основной признак неисправности проявляется в виде того, что на панели приборов Приора горит значок рулевого колеса с восклицательным знаком. Таким образом, ЭБУ уведомляет водителя о проблемах с усилителем руля.
Таким образом, ЭБУ уведомляет водителя о проблемах с усилителем руля.
В норме, при включении зажигания этот значок некоторое время горит и затем гаснет. Однако, если система неисправна, значок, указывающий на то, что электроусилитель Приоры неисправен, будет гореть постоянно.
Дело в том, что блок электроусилителя завязан на ЭБУ, то есть в памяти фиксируется ошибка. Это значит, что можно выполнить компьютерную диагностику. При этом подойдет даже простой индивидуальный сканер ELM 327. Главное, прочитать коды ошибок и расшифровать их. Ошибки ЭУР Приора обычно начинаются с литеры «С» (например, С1013, низкое напряжение).
Что касается наиболее частых проблем, силовые провода ЭУР (красного и черного цвета) могут ослабляться или подгорать. Еще из строя нередко выходит предохранитель ЭУР. Кстати, «просадки» по напряжению могут быть не связаны с усилителем. В этом случае нужно проверять состояние АКБ и работоспособность генератора.
Идем далее. Бывает и так, что значок руля на панели не горит, при этом водитель все равно замечает, что ЭУР на Приоре работает не так, как нужно. Для быстрой проверки нужно при выключенном зажигании покрутить руль, запоминая усилие. Далее заводят двигатель, после чего проверяют усилие. Если усилие одинаковое как при заглушенном, так и на заведенном ДВС, тогда есть основания полагать, что с электроусилителем возникли проблемы.
Для быстрой проверки нужно при выключенном зажигании покрутить руль, запоминая усилие. Далее заводят двигатель, после чего проверяют усилие. Если усилие одинаковое как при заглушенном, так и на заведенном ДВС, тогда есть основания полагать, что с электроусилителем возникли проблемы.
Частые неисправности электроусилителя руля и ремонт
Убедившись в том, что ЭУР не работает полностью или частично, необходимо прекратить эксплуатацию автомобиля. Далее следует провести проверку и попытаться точнее определить и локализовать неисправность. При этом возможных причин достаточно много.
Также от характера поломки будет зависеть и общая стоимость ремонта. В одних случаях нужна новая рулевая рейка на Приору, тогда как в других достаточно провести ревизию разъемов или контактов.
Обратите внимание, бывает так, что на модели Приора рулевая рейка вышла из строя (например, закусывает). При этом ЭУР в данном случае не является проблемой, так как рейка Приора относится не к усилителю, а к рулевому управлению. На деле, с поворотом руля могут возникнуть сбои, усилие увеличивается, однако сам ЭУР работает нормально и дело в механических частях самой рейки.
На деле, с поворотом руля могут возникнуть сбои, усилие увеличивается, однако сам ЭУР работает нормально и дело в механических частях самой рейки.
Еще добавим, обычно по части механики может возникать выход из строя валов, соединений и других элементов. По электрике не редки случаи отказа серводвигателя усилителя руля Приора. При этом лучше отказаться от попыток его ремонта и сразу купить новый ЭУР.
Также случается ситуация, когда блок ЭУР не может связаться с ЭБУ автомобиля. В этом случае часто подводит разъем 2 со шлейфом проводов. Также сигнал может не доходить до блока от внешних датчиков ДПКВ И ДПРВ, причем такая проблема оказывает прямое влияние на ЭУР.
Параллельно в списке неполадок стоит выделить и проблемы с блоком самого электроусилителя, а также датчики положения валов. Датчики лучше сразу менять, блок управления также рекомендуется заменить. При наличии инструментов, многие компоненты ЭУР удается поменять своими руками в условиях обычного гаража.
Как заменить электроусилитель руля на Приоре
Часто владельцы покупают ЭУР на Приору и меняют неисправные элементы усилителя самостоятельно. При этом рулевая рейка Приора с ЭУР находится не в самом доступном месте, однако все работы можно выполнить своими руками, так как, в отличие от ГУР, работать с самой рейкой не придется.
При этом рулевая рейка Приора с ЭУР находится не в самом доступном месте, однако все работы можно выполнить своими руками, так как, в отличие от ГУР, работать с самой рейкой не придется.
Подведем итоги
Как видно, ЭУР Приора сам по себе не является сложной конструкцией, что несколько упрощает процесс замены отдельных компонентов системы. Однако активное использование электроники снижает надежность такой системы в целом. На практике, чаще сбои в работе электроусилителя руля возникают не по причине механических поломок, а в результате проблем с разъемами, датчиками, контактами, проводкой, управляющими модулями и т.д.
Рекомендуем также прочитать статью о том, как заменить жидкость ГУР в гидроусилителе своими руками. Из этой стати вы узнаете об особенностях замены масла в гидроусилителе руля, когда менять масло ГУР и как выполняется замена.
В любом случае, применительно в ЭУР необходимо начинать с компьютерной диагностики, а уже затем переходить к углубленной проверке всех компонентов системы по отдельности.
Напоследок отметим, что игнорировать проблему с электроусилителем нельзя. Некоторые владельцы пытаются сбросить ошибки ЭУР, не определяя и устраняя причины. На самом деле, необходимо понимать, что исправное состояние и полная работоспособность усилителя руля является залогом комфортной и безопасной езды.
По этой причине усилитель рулевого управления, причем независимо от типа, необходимо периодически проверять и обслуживать (в случае с ГУР нужно следить за герметичностью и менять масло гидроусилителя, в случае с ЭУР, как минимум, следует выполнять углубленную диагностику). Такой подход дает возможность увеличить срок службы системы, а также позволяет избежать непредвиденных поломок усилителя рулевого управления автомобиля.
датчик момента, блок управления, схема, не работает
Содержание
- 1 Почему ЭУР на Приоре лучше, чем ГУР
- 2 Как устроен электроусилитель рулевого колеса
- 3 Определяем на Priora неисправности ЭУР
- 4 Используем «народный» метод проверки неисправности
- 5 Какие еще бывают неисправности и быстрые способы устранения
- 6 Снимаем ЭУР на Приоре и устанавливаем новый
- 7 Подведем итоги
У современных автомобилей, в том числе и Лада Приора, руль можно крутить хоть двумя пальцами, даже в то время пока машина припаркована, раньше, если кто не знает, такого не было.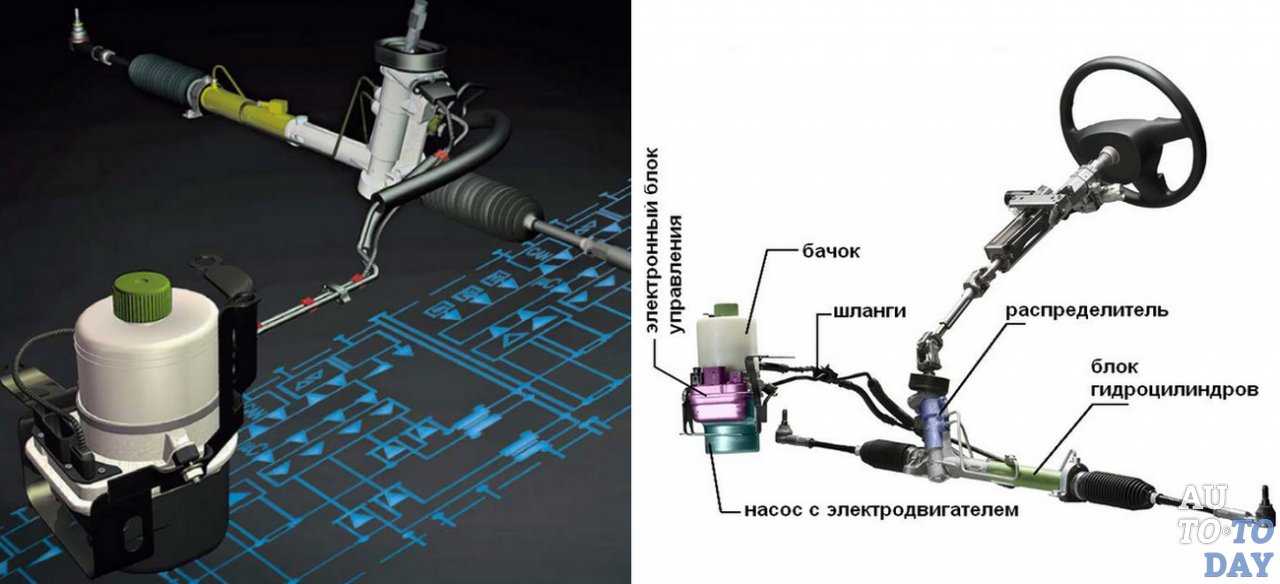 Благодаря современным технологиям появился электроусилитель руля. Однако, как многие знают, Приора, как и любое отечественное авто часто преподносит неожиданности, поэтому случаются ЭУР неисправности разного характера. В данном материале предлагаем разобраться, почему не работает такое крайне важное устройство, как электроусилитель руля и какие бывают способы устранения неприятностей связанных с этим.
Благодаря современным технологиям появился электроусилитель руля. Однако, как многие знают, Приора, как и любое отечественное авто часто преподносит неожиданности, поэтому случаются ЭУР неисправности разного характера. В данном материале предлагаем разобраться, почему не работает такое крайне важное устройство, как электроусилитель руля и какие бывают способы устранения неприятностей связанных с этим.
Почему ЭУР на Приоре лучше, чем ГУР
Благодаря ЭУР происходит более мощное усилие, передающееся в систему так сказать рулевого управления автомобилем. Если говорить простыми словами, то с таким устройством руль сидящий за ним, может крутить хоть 2-мя пальцами. Раньше на всех автомобилях представленных автомобилестроительной компанией «АвтоВАЗ» устанавливали ГУР, однако, с Калины от них руководством компании было решено отказаться, и перешли на более современные ЭУР.
Многие автовладельцы скажут, что гидроусилитель руля по своей мощности передачи намного предпочтительнее, однако, он имеет предостаточно недостатков, среди которых:
- Необходима регулярная проверка маслопроводов.

- Регулярно следует проверять и уровень в бачке.
- Силовой агрегат теряет в мощности.
Рассматриваемый нами сегодня электроусилитель руля, который установлен на Лада Приора, не имеет таких очевидных минусов, тем более в ремонте он прост, чем все тот же ГУР. Однако устройство не лишено, пусть и незначительных, но недостатков, случается даже так что, то работает то нет.
Как устроен электроусилитель рулевого колеса
Рассматриваемое нами в данном материале автомобильное устройство на Лада Приора, состоит из следующих компонентов:
- ЭБУ с соответствующей периферией. В этом блоке присутствуют разъемы со специальными датчиками.
- Электрическая часть. Данная часть является мотором устройства. Преимущественно этот компонент самый уязвимый.
- Механическая составляющая. Сюда включены элементы рулевого управления, крепеж и соединительные части. Этот компонент состоит: регулировочный рычаг, необходимый дабы сменить угол наклона рулевого колеса, а также выходной и входной валы, тут можно еще добавить пружины, присутствующие гайки, не пропустим шпильки и болты.

Определяем на Priora неисправности ЭУР
Самый главный признак ЭУР неисправности – когда срабатывает на приборной автомобильной панели лампочка, получающая сигнал от ЭБУ. В стандартной комплектации отечественной Лада Приора на «приборке» имеет такой значок, выполненный в виде колеса и восклицательного знака. Когда вы включаете в своем авто зажигание, то этот значок буквально на несколько секунд загорается, после чего гаснет, когда компьютер понимает, что все в порядке. Если же что-то не работает, то сигнал загорается и не перестает гореть до полного устранения неисправности.
Если лампочка горит, то самое верное решение в такой ситуации это пройти компьютерную диагностику, поскольку электроусилитель руля напрямую связан с бортовым компьютером Лада Приора. В настоящее время можно без труда приобрести диагностический индивидуальный сканер, которыми легко пользоваться и вы сможете легко и просто узнать причину неисправности, дабы самостоятельно выбрать способы устранения этой самой неисправности.
Итак, опытные водители рекомендуют провести диагностику, сделать это можно самостоятельно, имея под рукой соответствующее устройство. Вы сможете связаться с головным компьютером и получить все коды ошибок, причем неважно будут они без расшифровки или с ней. Если ваш сканер выдал вам лишь коды, не стоит отчаиваться, все легко можно узнать. Достаточно знать, что ЭУР неисправности обязательно будут начинаться с символа «С», к примеру, такой код как С1013 означает, что в сети слишком низкое напряжение, а ЭУР этого недостаточно.
Собственно при данной неисправности, вероятно, произошло ослабление, а возможно пригорание 1-го из 2-ух имеющихся силовых проводов, которые идут на усилитель руля. Провода там черный и красный большого сечения и входят они всегда в отдельный разъем на нашем устройстве, проверить их не составит труда. Также как вариант может быть неисправен предохранитель, с этой проблемой вообще все понятно и легко ее устранить. Еще одна причина, когда ЭУР не работает, это когда генератор или аккумулятор неисправен. Если причина кроется в этом, то тут без хорошего специалиста электрика не обойтись никак.
Если причина кроется в этом, то тут без хорошего специалиста электрика не обойтись никак.
Противотуманные фары Лада Веста
Краш тест авторевю Веста
Лада Веста клиренс дорожный просвет
Используем «народный» метод проверки неисправности
В случае, когда на LADA Priora не горит лампочка, а ЭУР неисправности присутствуют, а возможно, требуется провести контроль, после проведенных ремонтных работ, то можно сделать так: покрутите автомобильный руль, без включенного зажигания, запомните при этом усилие. Далее запустите двигатель и повторите действие. Если нет никаких изменений между двумя действиями, то очевидно, что ЭУР не в порядке, нужна более детальная диагностика авто, после чего выбрать наиболее подходящие способы устранения неисправности, и это, скажем вам, совсем не проблематично.
Какие еще бывают неисправности и быстрые способы устранения
Вспоминаем опять составляющие ЭУР механика, электроника и соответственно электрика. С все той же механикой все более чем ясно и понятно, случается выход из строя компонентов: арматуры, вероятно соединений и/или валов. Если неисправность кроется в этом то, колеса вашей LADA Priora вообще не будут крутиться при движении рулевого колеса.
С все той же механикой все более чем ясно и понятно, случается выход из строя компонентов: арматуры, вероятно соединений и/или валов. Если неисправность кроется в этом то, колеса вашей LADA Priora вообще не будут крутиться при движении рулевого колеса.
В случае, когда неисправности кроются в другом, то дело обстоит сложнее. Когда удается понять, что из строя вышел усилитель или же сервомотор, то даже не стоит задумываться о ремонтных работах, в таком случае нужно приобрести новый усилитель и произвести замену. Если вы обнаружили, что между электроусилителем и автомобильным головным компьютером пропала связь, то причина кроется во 2-ом разъеме, то же самое, когда не поступает сигнал в блок от распределительного или коленчатого валов. Да, они крайне важны для работы устройства. В этой ситуации лучше отремонтировать или заменить провода.
Осталась элекронника устройства, и внутренние датчики положения валов. С этими самыми датчиками самостоятельно ничего сделать не получится, лучший вариант это ремонт в условиях автосервиса. Неисправность компьютера устраняется самостоятельно, вам необходимо купить его и установить.
Неисправность компьютера устраняется самостоятельно, вам необходимо купить его и установить.
Снимаем ЭУР на Приоре и устанавливаем новый
Когда ЭУР на вашем авто то работает то нет, и вы выявили причины, по которым понятно, что ремонтировать устройство бесполезно, нужно поменять усилитель на новый. Сделать это вы можете затратив немного времени и усилий, но все же своими руками.
Инструменты, необходимые для замены ЭУР на LADA Priora:
- Крестовая отвертка самая обыкновенная.
- Головка на «13», основной инструмент.
- Пригодится и ключ накидной на «8».
Пошаговая инструкция по замене ЭУР на Приоре:
- Первым делом обязательно требуется отключить аккумуляторную батарею, достаточно будет «скинуть» минусовую клемму.
- Снимаем с рулевой колонки пластиковые накладки, для этого отстегиваем пару фиксаторов и выкручиваем пару саморезов.
- Выкручиваем 4-е болта и отделяем свободно, но аккуратно нижнюю часть пластиковой закрывающей накладки.

- На данном этапе мешает замок и рычаги-переключатели понятное дело, дворников и поворотов. Не спеша, отключаем все провода и ключом на «8» требуется ослабить хомут, крепящий все выше перечисленные устройства. Они легко отходят с кожуха вала.
- Отсоединяем 2 разъема от электронного блока управления. Снимаем пластиковую накладку со специальной шпильки.
- Нижние гайки не нужно откручивать, достаточно повернуть их буквально на несколько оборотов.
- Далее, извлеките стяжной болт шарниров.
- Выкручиваем все оставшиеся крепежные гайки.
- Извлекаем ЭУР.
- Устанавливаем новый усилитель, и собираем все в обратной последовательности. Важно ничего не перепутать.
Подведем итоги
Все неисправности электроусилителя можно диагностировать самостоятельно на Приоре. Конечно же, не все неисправности вы сможете самостоятельно устранить, но замену устройства выполнить вполне реально, используя для этого пошаговую инструкцию.
youtube.com/embed/88DBmEksXik» frameborder=»0″ allowfullscreen=»allowfullscreen»>диагностика неисправностей, монтаж и демонтаж
28.09.20224 763 3 3 ВАЗ Priora
Автор:Иван Баранов
На автомобиле Лада Приора такое устройство, как электроусилитель руля, предлагается в стандартной комплектации, как функция комфорта. Именно об этом устройстве мы поговорим в этой статье. Предлагаем вам узнать, с какими неисправностями может столкнуться автовладелец этого авто и как произвести замену узла самостоятельно.
Содержание
- 1 Роль электроусилителя в рулевом управлении ВАЗ 2170 Приора
- 2 Распространенные неисправности и способы их устранения
- 2.1 Как определить механические повреждения ЭУР и рулевых механизмов?
- 3 Снятие и установка ЭУР в домашних условиях
- 4 Видео «Установка усилителя своими руками»
[ Раскрыть]
[ Скрыть]
Роль электроусилителя в рулевом управлении ВАЗ 2170 Приора
Электроусилитель Приоры в снятом видеНи для кого не секрет, что электрический способ управления играет немаловажную роль в обеспечении безопасности во время езды. ЭУР или ГУР Приора выполняет опцию понижения уровня нагрузки на руль во время его поворота. Ключевым преимуществом использования такого устройства ЭУР на Приоре является комфорт при передвижении в результате улучшенной обратной связи между рулем и колесами.
ЭУР или ГУР Приора выполняет опцию понижения уровня нагрузки на руль во время его поворота. Ключевым преимуществом использования такого устройства ЭУР на Приоре является комфорт при передвижении в результате улучшенной обратной связи между рулем и колесами.
Электроусилитель представляет собой более современный и усовершенствованный узел, который не только проще в плане использования, но и не требует внедрения дополнительных магистралей для обеспечения работы. Кроме того, данное устройство не забирает мощность у силового агрегата. Главное достоинство ЭУР — не требует частого ТО и контроля жидкости в отличии от ГУР.
Но следует отметить, что такая система имеет несколько недостатков, один из них — довольно слабая обратная связь между дорожным покрытием и системой управления. В результате этого при езде по снегу могут появиться трудности. В отличие от Приор, иномарки оснащаются дополнительными механизмами и узлами блокировки и стабилизации, поэтому способ управления ЭУР в отечественном варианте является менее надежным. Помимо этого, на практике неисправный электроусилитель с плохой тягой — это достаточно распространенное явление.
Помимо этого, на практике неисправный электроусилитель с плохой тягой — это достаточно распространенное явление.
Распространенные неисправности и способы их устранения
С поломками устройств сталкиваются многие приороводы, в частности, речь идет о неисправности именно блока управления. Если блок управления системой работает некорректно или вышел из строя, на дисплее бортового компьютера появится соответствующая ошибка. Расшифровав ее, можно понять, что компьютер сообщает об отказе работы подключения ЭУР, что в большинстве случаев говорит о наличии проблем в пайке. В частности, речь идет о месте соединения платы усилителя с контроллером.
Данная неисправность решается либо путем замены системы у дилера, если авто на гарантии, либо путем ремонта. Если у вас нет опыта в чип-тюнинге или работы с электронными девайсами, то решение такой неисправности необходимо доверить профессионалам. Разумеется, для того, чтобы точно поставить «диагноз», потребуется провести компьютерную диагностику.
Часто случается такое, что происходят сбои в работе датчика скорости, что опять же, способствует появлению ошибки бортового компьютера. Такой тип неисправности можно решить путем перепрограммирования устройства либо заменой проводов в тех местах, где регулятор соединяется с контроллером. Если сам регулятор является нерабочим, то его придется заменить (автор видео — Алексей a-skorp).
Слишком низкий уровень напряжения в бортовой сети авто — это также распространенная проблема. В данном случае необходимо в первую очередь уделить внимание диагностике генераторного устройства либо проводки. Для проверки используйте тестер. В любом случае, если в работе системы обнаружены неполадки, необходимо произвести ремонт рулевой рейки своими руками. Эксплуатация авто с неработающим ЭУР не допускается до полного устранения проблемы.
Как определить механические повреждения ЭУР и рулевых механизмов?
Механическая диагностика осуществляется в том случае, если электроусилитель руля работает не нормально, но при этом бортовой компьютер не выдает ошибок. Чтобы произвести проверку механических повреждений, необходимо максимально провернуть рулевое колесо влево и вправо, мотор при этом должен быть заведен. Следует отметить, что при повороте рулевого колеса транспортное средство должно стоять на одном месте.
Чтобы произвести проверку механических повреждений, необходимо максимально провернуть рулевое колесо влево и вправо, мотор при этом должен быть заведен. Следует отметить, что при повороте рулевого колеса транспортное средство должно стоять на одном месте.
В том случае, если вы заметили, что при повороте руля необходимо приложить больше усилий, чем обычно, то это может свидетельствовать о выходе из строя деталей или компонентов усилителя. Но также это может говорить о поломке других элементов рулевой системы (видео о диагностике усилителя руля с помощью скрепки представлено ниже, автор видео — Гоша Вахромеев).
Чтобы точно выявить, что же послужило проблемой, потребуется провести более тщательную диагностику. Для этого транспортное средство в первую очередь нужно загнать на подъемник и поднять, при этом тщательно проверив на работоспособность все элементы ходовки. Проверке подлежат рейки, рулевые тяги и т.д. Такую процедуру можно без проблем провести на любом СТО либо же своими силами, но только если у вас есть подъемник и определенные навыки по диагностике. Есть вероятность того, что ремонт ЭУР не требуется, поскольку он сам по себе работоспособен, но требуется ремонт других элементов.
Проверке подлежат рейки, рулевые тяги и т.д. Такую процедуру можно без проблем провести на любом СТО либо же своими силами, но только если у вас есть подъемник и определенные навыки по диагностике. Есть вероятность того, что ремонт ЭУР не требуется, поскольку он сам по себе работоспособен, но требуется ремонт других элементов.
Чтоб не допустить появления неисправностей, связанных с электроусилителем, необходимо время от времени производить очистку системы, а также контактных узлов. Чтобы провести сервисное обслуживание самостоятельно, потребуется снять свой ЭУР, полностью разобрать его, произвести очистку и поставить обратно. Подробнее об этом мы расскажем ниже.
Снятие и установка ЭУР в домашних условиях
Для того, чтобы произвести снятие устройства с автомобиля, потребуется заранее подготовить все, что вам может пригодиться в процессе. В частности, речь идет об отвертках с плоским и крестовым наконечниками, а также наборе гаечных ключей с торцевыми головками.
Итак, как происходит процедура снятия и монтажа электроусилителя:
- В первую очередь, необходимо выключить питание на бортовую сеть, для этого отсоедините минусовую клемму от аккумулятора.
 Затем демонтируйте руль, заранее сняв пластиковую накладку под ним и на контрольном щитке. Демонтаж руля проводится в соответствии с сервисной книжкой к автомобилю.
Затем демонтируйте руль, заранее сняв пластиковую накладку под ним и на контрольном щитке. Демонтаж руля проводится в соответствии с сервисной книжкой к автомобилю. - Используя крестообразную отвертку, необходимо открутить четыре болта фиксации декоративной накладки на рулевой панели.
- Сделав это, вы сможете увидеть колодки с проводкой — их необходимо отсоединить от подрулевого переключателя, также отсоединяется и контактное кольцо.
- Используя гаечный ключ на 8, нужно открутить винт фиксации колодок проводов, которые проходят от замка зажигания.
- Далее, необходимо нажать на пластмассовые элементы фиксации и отсоединить колодки с проводами вверху и внизу самой колонки.
- В том месте, где электроусилитель рулевого колеса крепится к самой колонке, потребуется демонтировать так называемую пластмассовую шторку, для этого следует отсоединить фиксаторы.
- Используя торцевой ключ, нужно несильно ослабить гайки, которые фиксируют узел к низу колонки.
 Отсоедините колодку от подрулевых переключателей. 2. Разъедините колодки кабелей замка зажигания. 3. Произведите демонтаж усилителя.
Отсоедините колодку от подрулевых переключателей. 2. Разъедините колодки кабелей замка зажигания. 3. Произведите демонтаж усилителя.После выполнения этих действий осуществляется снятие непосредственно усилителя — он демонтируется вместе с промежуточным валом. Но для того, чтобы вам было более удобно прочищать узел и в дальнейшем производить установку в обратном порядке, эти компоненты желательно заранее отсоединить друг от друга. Чтобы сделать это, используя ключ на 13 выкрутите винт, фиксирующий карданный шарниры на самом валу. Затем вам потребуется открутить две гайки фиксации по торцам, после этого саму рулевую колонку можно будет извлечь.
Затем нужно будет извлечь винт и произвести снятие кардана от шлицевого шкива узла. Чтобы после снятия процедура обратной установки была более удобной, желательно удостоверить в том, что все метки совпадают. Речь идет о метках на защитном чехле, шкиве, а также крышке стартера. Очистка механизма контактной группы и прочих элементов системы должна производиться осторожно, чтобы все компоненты остались целыми и неповрежденными. Если вы обратитесь за помощью к специалистам в этом вопросе, то процедура очистки обойдется вам в среднем около 30-50 долларов в зависимости от региона.
Если вы обратитесь за помощью к специалистам в этом вопросе, то процедура очистки обойдется вам в среднем около 30-50 долларов в зависимости от региона.
Загрузка …
Видео «Установка усилителя своими руками»
Как правильно произвести монтаж электроусилителя в домашних условиях — смотрите на видео ниже (автор видео — sokur64).
Была ли эта статья полезна?
Спасибо за Ваше мнение!
Статья была полезнаПожалуйста, поделитесь информацией с друзьями
Да (100.00%)
Нет
история неисправного усилителя руля — журнал За рулем
LADA
УАЗ
Kia
Hyundai
Renault
Toyota
Volkswagen
Skoda
Nissan
ГАЗ
BMW
Mercedes-Benz
Mitsubishi
Mazda
Ford
Все марки
История с распоясавшимся электроусилителем на редакционной «Ладе-Приора» продолжается. О реакции на статью в Тольятти и поездке на завод «Автоэлектроника».
О реакции на статью в Тольятти и поездке на завод «Автоэлектроника».
1
Нельзя, конечно, оценивать работу таких огромных коллективов по машинам, которые они клепают.
М. Жванецкий
Напомню суть проблемы: у нас ломался электроусилитель, самопроизвольно вывернув колеса на встречную полосу. АВТОВАЗ заменил дефектный узел. Выяснилось, что поставщик усилителя, калужский завод «Автоэлектроника», вместо дорогого немецкого модуля управления поставил свой собственный. По словам представителей «Автоэлектроники», на замещение импорта отечественным блоком ушло почти два года и об этих работах в Тольятти знали. Проблемы возникли лишь при стыковке нового модуля с общей платой контроллера — пайка была недостаточно хороша, что и вылилось в большую волну неполадок. С декабря 2010 года по февраль 2011-го по гарантии пришлось заменить 1938 ЭУРов. При норме не более трех бракованных изделий на тысячу штук в тот период случился обвал — 21,3 на ту же тысячу!
Впрочем, на АВТОВАЗе ничего страшного не увидели. Из ответа пресс-центра автозавода: «В процессе совместной проверки специалистами АВТОВАЗа и предприятия-поставщика всех случаев обращения потребителей в сервисные центры с жалобой на некорректную работу электроусилителя установлено, что выявленное количество неисправностей не носит массовый характер. Проведена работа по замене электроусилителей из партии, попавшей под подозрение. Дирекция по качеству АВТОВАЗа ведет ежедневную работу по выявлению любых возможных дефектов и своевременному их устранению».
Из ответа пресс-центра автозавода: «В процессе совместной проверки специалистами АВТОВАЗа и предприятия-поставщика всех случаев обращения потребителей в сервисные центры с жалобой на некорректную работу электроусилителя установлено, что выявленное количество неисправностей не носит массовый характер. Проведена работа по замене электроусилителей из партии, попавшей под подозрение. Дирекция по качеству АВТОВАЗа ведет ежедневную работу по выявлению любых возможных дефектов и своевременному их устранению».
Однако дефект проявлялся у всех по-разному: кто-то успел проехать не более 400 км, мой сломался при пробеге 22 692 км! Возможно, чей-то ЭУР просто еще не «выстрелил». Ничего страшного не произошло и по мнению разработчиков: «Внезапные переходы ЭМУРУ 2172-345008-02 из режима „компенсация“ в режим „отказ“ при различных скоростях и режимах движения не приводят к снижению безопасности управления автомобиля „Лада-2170“.
Прежде чем отправить на конвейер, ЭМУРУ обкатывают на стенде в течение 45 минут с 30‑процентной нагрузкой.

Прежде чем отправить на конвейер, ЭМУРУ обкатывают на стенде в течение 45 минут с 30‑процентной нагрузкой.
Прежде чем отправить на конвейер, ЭМУРУ обкатывают на стенде в течение 45 минут с 30‑процентной нагрузкой.
Сегодня «Автоэлектроника» вложила более миллиона евро в модернизацию оборудования, чтобы повысить качество продукции, полностью уйдя от ручного труда. Видно, эта история заметно встряхнула калужан и они извлекли определенный урок.
АВТОВАЗ эту ситуацию тоже использовал, но в своих целях, натянув поводок для проштрафившегося поставщика. «Приора» простоит на конвейере до 2016 года, дальше перспективы калужского усилителя туманны. На «Калину», а тем более на «Гранту», его не пускают, а больше его и ставить некуда.
Здорово, конечно, что заводы откликнулись на публикацию, но мы неслучайно вынесли в эпиграф цитату из Жванецкого. Или наш усилитель оказался единственным в своем роде устройством, перед своей кончиной чуть не лишившим жизни водителя, или нам опять чего-то недоговаривают. В общем, тема еще не закрыта.
В общем, тема еще не закрыта.
ИТАК, НАЛИЧИЕ ДЕФЕКТА ЗАВОДЫ ПРИЗНАЛИ, ПАРУ ТЫСЯЧ УЗЛОВ ЗАМЕНИЛИ. НО ДО КОНЦА ЛИ РЕШЕНА ПРОБЛЕМА, НЕ ПРОЯВИТСЯ ЛИ ВНОВЬ ОПАСНЫЙ ДЕФЕКТ? ВМЕСТО ОТВЕТА — ДЕЖУРНАЯ ФРАЗА О «ЕЖЕДНЕВНОЙ РАБОТЕ ПО ВЫЯВЛЕНИЮ». ЧТОБЫ ВЕРНУТЬ ПОКУПАТЕЛЯМ СПОКОЙСТВИЕ, ЭТОГО ЯВНО МАЛО…
Мощность завода — 100 тыс. усилителей в год, но «Автоэлектроника» мечтает о 300 тысячах.
Мощность завода — 100 тыс. усилителей в год, но «Автоэлектроника» мечтает о 300 тысячах.
Мощность завода — 100 тыс. усилителей в год, но «Автоэлектроника» мечтает о 300 тысячах.
Lada Priora: история неисправного усилителя руля
История с распоясавшимся электроусилителем на редакционной «Ладе-Приора» продолжается. О реакции на статью в Тольятти и поездке на завод «Автоэлектроника».
Lada Priora: история неисправного усилителя руля
Lada Priora: история неисправного усилителя руля
История с распоясавшимся электроусилителем на редакционной «Ладе-Приора» продолжается.
 О реакции на статью в Тольятти и поездке на завод «Автоэлектроника».
О реакции на статью в Тольятти и поездке на завод «Автоэлектроника».Lada Priora: история неисправного усилителя руля
Наше новое видео
Тест нового кроссовера. Опять «китаец»? Не совсем
На каких самокатах нельзя ездить по тротуарам?
Аурус Комендант — подробный обзор
Понравилась заметка? Подпишись и будешь всегда в курсе!
За рулем на Яндекс.Дзен
Отзывы о LADA Priora (4)
Безымянный
LADA Priora 2009 / срок владения 3 — 5 лет
Достоинства:
Шустрая, низкий расход топлива, удобный багажник у хетчебека.
Недостатки:
Ломучесть. КПП к 200 тыс.км потеряла 2ю и 5ю передачи. Масло в свечных колодцах- катушки как расходники. Помпа живёт не более 90тыс.км. моторчики заслонок печки , трещины в задней балке ,двух массовый шкиф ремня генератора генератор и стартер менял по 2 раза. Просело ко второму кругу сиденье и за…
Просело ко второму кругу сиденье и за…
Комментарий:
Написать отзыв
Новости smi2.ru
Знак CE для медицинских устройств
ОТВЕТЫ НА ЭТОЙ СТРАНИЦЕ:
- Что такое знак CE ЕС и что он означает?
- Что представляет собой процесс маркировки медицинского изделия CE для Европы?
- Кто отвечает за соблюдение нормативных требований в Европе?
Что такое маркировка CE для медицинских устройств?
Чтобы продавать медицинские устройства в Европейском союзе (ЕС), вы должны получить маркировку СЕ для своего продукта. Маркировка CE указывает на то, что ваше медицинское устройство соответствует применимым нормам ЕС и позволяет продавать вашу продукцию во всех странах-членах ЕС. Как законный производитель медицинского оборудования, вы несете ответственность за соблюдение нормативных требований и обеспечение маркировки СЕ для своего продукта, независимо от того, передаете ли вы какие-либо или все компоненты своей производственной операции на аутсорсинг. Производители медицинских устройств для диагностики in vitro (IVD) должны соответствовать аналогичным требованиям к маркировке CE в Европе.
Производители медицинских устройств для диагностики in vitro (IVD) должны соответствовать аналогичным требованиям к маркировке CE в Европе.
Имея офисы по всей Европе, специалисты по регулированию Emergo могут помочь вам получить маркировку СЕ для вашего медицинского устройства и начать продавать вашу продукцию в ЕС.
Как получить европейскую маркировку CE для вашего медицинского устройства
CE не является знаком качества, но соответствие Регламенту ЕС о медицинских устройствах (MDR 2017/745) требует от вас соблюдения определенных стандартов производительности, качества, безопасности и эффективности. для вашего типа продукта. У нас есть подробная диаграмма, объясняющая текущий процесс утверждения медицинского оборудования в Европе CE. Однако основной процесс состоит из следующих шагов:
- Определите, соответствует ли ваш продукт определению медицинского устройства в соответствии с MDR.
- Определите классификацию вашего устройства. Смотрите нашу диаграмму.

- Внедрите систему управления качеством, если это применимо к вашему устройству. Большинство компаний используют ISO 13485 для выполнения требований.
- Подготовить технический файл маркировки CE или проектное досье.
- Подготовьте отчет о клинической оценке (CER) в соответствии с MEDDEV 2.7/1 rev4 и MDR.
- Выберите и назначьте европейского уполномоченного представителя (EC REP), который будет действовать от вашего имени в ЕС, если у вас нет физического местонахождения в Европе.
- Проведите аудит вашей системы менеджмента качества и технического файла/проектного досье уполномоченным органом, если только ваше устройство не относится к классу I, не является стерильным и не имеет измерительной функции.
- Получите сертификаты CE Marking и ISO 13485 от уполномоченного органа.
- Подготовьте Декларацию о соответствии (DoC), в которой указано, что ваше устройство соответствует MDR.
Чтобы получить дополнительную информацию о соответствии Регламенту ЕС о медицинских устройствах, загрузите нашу белую книгу MDR.
Emergo может помочь вам получить маркировку ЕС CE для вашего медицинского устройства. Мы помогли сотням производителей медицинского оборудования обеспечить соответствие требованиям СЕ для Европы. Наши услуги включают:
- Помощь в классификации продуктов
- Проверка применимых стандартов и требований к испытаниям
- Составление технического файла или проектного досье или просмотр ваших файлов
- Обзор существующих маркетинговых материалов, маркировки и информации в руководстве пользователя для обеспечения соответствия и последовательности
- Проверка соответствия основным требованиям
- Подготовка отчета о клинической оценке на основе предоставленных клинических данных
- Внедрение, изменение и поддержание системы качества (обычно ISO 13485), которая будет соответствовать европейским и другим международным требованиям
- Услуги уполномоченного представителя в Европе
- Оценка рисков и управление ими (ISO 14971)
- Разработка процедур бдительности и послепродажного надзора
Свяжитесь с нами, чтобы узнать, как мы можем помочь вам получить маркировку CE для вашего медицинского устройства в Европе.
Часто задаваемые вопросы о маркировке СЕ
Как долго действует сертификат СЕ?
При действующей системе сертификаты CE, выдаваемые уполномоченными органами, обычно действительны в течение трех лет. Срок действия может составлять только один год для некоторых устройств с высоким уровнем риска. Однако статус вашей сертификации CE зависит от поддержания вашей сертификации системы качества.
Наше устройство уже имеет маркировку CE. Как MDR 2017/745 влияет на наш статус?
Регламент MDR полностью вступил в силу в мае 2021 г. Максимальный срок действия сертификатов, выданных до окончательного внедрения MDR, составляет пять лет. Однако срок действия всех сертификатов CE Mark, выданных до вступления в силу новых правил, автоматически истекает через четыре года после вступления новых правил в силу.
Кто выдаст мой сертификат маркировки CE?
Если ваше медицинское изделие относится к Классу I (при условии, что оно стерильно или имеет измерительную функцию), Классу IIa, IIb или III, или если ваш IVD подпадает под Приложение II, Список A; Приложение II, список B или самопроверка, вы получите сертификат CE от уполномоченного органа. Нестерильные, неизмерительные устройства класса I и общие/другие IVD могут пройти самостоятельную сертификацию и не требуют сертификата CE от уполномоченного органа.
Нестерильные, неизмерительные устройства класса I и общие/другие IVD могут пройти самостоятельную сертификацию и не требуют сертификата CE от уполномоченного органа.
Отображается ли название уполномоченного органа на этикетке моего продукта?
Их имя не будет отображаться, но их четырехзначный номер NB появится под знаком CE на вашей этикетке.
Повлияет ли смена контрактного производителя на мою сертификацию CE?
Да, потому что это изменение важных поставщиков. В этой ситуации легальные производители (т. е. «владельцы» маркировки СЕ) выберут нового контрактного производителя на основе критериев, изложенных в их системе качества, которая должна описывать, как квалифицировать и постоянно оценивать своих поставщиков.
Официальный производитель должен уведомить свой уполномоченный орган об этом изменении и запросить обновленный сертификат CE. Уполномоченный орган может потребовать проведения выездной проверки нового контрактного производителя для выдачи обновленного сертификата СЕ.
Регулирование медицинского оборудования в Европе – что меняется и как я могу принять более активное участие?
В последнее время средства массовой информации уделяют большое внимание регулированию медицинских устройств, особенно имплантируемых или устройств высокого риска. Совсем недавно опубликованный в ноябре 2018 года аналитический материал, подготовленный в сотрудничестве с международными журналистами, попал на первые полосы мировых новостей. Во многих странах власти и врачи, казалось, попали не в ту ногу и оказались в положении реакции, а не действия. Однако в Европе реформирование процессов регулирования медицинских изделий продолжается уже несколько лет. Поскольку кардиологические устройства являются одними из наиболее часто используемых устройств высокого риска в клинической практике, наше сообщество страдает больше, чем другие специальности. Действительно, среди профессиональных сообществ Европейское общество кардиологов лидировало в отстаивании улучшенного регулирования на протяжении большей части последнего десятилетия1 9. 0111 , 2.
0111 , 2.
Медицинские устройства скоординировано регулируются по всей Европе с 1990-х годов. В то время были опубликованы первые общеевропейские директивы по медицинским изделиям (MDD) в 1990 и 19933 , 4 . За последнее десятилетие возник ряд скандалов, касающихся пациентов, пострадавших в результате лечения утвержденными медицинскими изделиями. К ним относятся скандал с грудными имплантатами Poly Implant Prothèse (PIP), разногласия по поводу замены тазобедренного сустава металл на металл и осложнения после имплантации вагинальной сетки. Хотя скандал с грудными имплантатами PIP оказался скорее случаем мошенничества, чем сбоя процессов утверждения, нотифицированный орган, ответственный за оценку соответствия продукта, был признан ответственным за ущерб из-за сбоев в мониторинге производителя5.
В то же время были предприняты первые шаги по пересмотру процессов регулирования устройств в Европе с осознанием того, что MDD устарел. Общая цель инициативы — повысить клиническую безопасность медицинских изделий на рынке Европы, а также повысить доверие и репутацию системы надзора. Кульминацией этих процессов стала публикация нового регламента по медицинским изделиям (MDR) в мае 2017 г.6. Параллельно был опубликован отдельный регламент, касающийся диагностика in vitro . Регламенты, в отличие от директив, сразу же становятся законом во всех государствах-членах. В настоящее время мы находимся в середине переходного периода продолжительностью три года, что позволяет оценивать устройства либо в соответствии с MDD, либо в соответствии с MDR; это закончится в мае 2020 года. По истечении этого времени все медицинские устройства должны быть одобрены в соответствии с процессами MDR. Сертификаты устройств, уже представленных на рынке, известных как устаревшие устройства, будут действовать еще четыре года до мая 2024 года9.0003
Кульминацией этих процессов стала публикация нового регламента по медицинским изделиям (MDR) в мае 2017 г.6. Параллельно был опубликован отдельный регламент, касающийся диагностика in vitro . Регламенты, в отличие от директив, сразу же становятся законом во всех государствах-членах. В настоящее время мы находимся в середине переходного периода продолжительностью три года, что позволяет оценивать устройства либо в соответствии с MDD, либо в соответствии с MDR; это закончится в мае 2020 года. По истечении этого времени все медицинские устройства должны быть одобрены в соответствии с процессами MDR. Сертификаты устройств, уже представленных на рынке, известных как устаревшие устройства, будут действовать еще четыре года до мая 2024 года9.0003
Итак, каковы новые функции MDR и как кардиолог может внести свой вклад в повышение безопасности пациентов? Кроме того, каковы новые обязанности врачей и больниц и каковы новые возможности для участия? (Рисунок 1, Таблица 1)
Рисунок 1. Основные особенности новых правил, касающихся медицинских изделий и диагностики in vitro. Воспроизведено с разрешения Европейской комиссии.
Основные особенности новых правил, касающихся медицинских изделий и диагностики in vitro. Воспроизведено с разрешения Европейской комиссии.
Новые возможности системы регулирования
Исторически сложилось так, что устройства в Европе не утверждаются, а получают оценку соответствия уполномоченными органами, которая, если она проходит, приводит к выдаче знака CE. При оценке соответствия планкой, которую необходимо достичь, является «безопасность и производительность в соответствии с назначением». Это существенно отличается от «безопасности и эффективности», которое является стандартным требованием в некоторых других юрисдикциях. В рамках MDR требования для утверждения устройств с высоким риском с точки зрения клинических доказательств станут более строгими. Это развитие будет приветствоваться большинством пациентов и врачей. В новом MDR говорится, что устройства с высоким риском должны демонстрировать «клиническую пользу», что, по-видимому, является важным повышением планки. Тип клинических данных, которые потребуются для утверждения устройств, будет определяться рабочей группой регулирующих органов по внедрению, которая получает информацию от различных заинтересованных сторон, включая ESC. В то же время мы, как врачи, заинтересованы в том, чтобы наши пациенты как можно быстрее сохранили доступ к инновационным устройствам, особенно в областях, где существует явная неудовлетворенная потребность в устройствах. Влияние изменений в MDR на доступ к новым устройствам впервые станет очевидным в ближайшие годы. Хотя для инновационных устройств не планируется отдельного пути прорыва, предполагается, что устройства, удовлетворяющие неудовлетворенные клинические потребности, будут по-прежнему своевременно доступны для пациентов.
Тип клинических данных, которые потребуются для утверждения устройств, будет определяться рабочей группой регулирующих органов по внедрению, которая получает информацию от различных заинтересованных сторон, включая ESC. В то же время мы, как врачи, заинтересованы в том, чтобы наши пациенты как можно быстрее сохранили доступ к инновационным устройствам, особенно в областях, где существует явная неудовлетворенная потребность в устройствах. Влияние изменений в MDR на доступ к новым устройствам впервые станет очевидным в ближайшие годы. Хотя для инновационных устройств не планируется отдельного пути прорыва, предполагается, что устройства, удовлетворяющие неудовлетворенные клинические потребности, будут по-прежнему своевременно доступны для пациентов.
Усиливаются требования, если производитель хочет получить одобрение нового медицинского изделия на основании демонстрации эквивалентности уже находящемуся на рынке изделию. Это усложнит получение одобрения устройствами «я тоже» на основе данных с других устройств. Однако это не должно защищать от прорывных устройств. Кроме того, представление данных, собранных в рамках программ благотворительного использования, будет затруднено. В некоторых случаях это воспринималось как черный ход для получения оценки уполномоченным органом в обход более строгих клинических исследований.
Однако это не должно защищать от прорывных устройств. Кроме того, представление данных, собранных в рамках программ благотворительного использования, будет затруднено. В некоторых случаях это воспринималось как черный ход для получения оценки уполномоченным органом в обход более строгих клинических исследований.
Второе важное изменение связано с повышением прозрачности7. В прошлом было трудно получить доступ к информации, которая позволяла нотифицированному органу выдавать сертификат соответствия на устройство. В соответствии с MDR производитель должен публиковать сводку по безопасности и клиническим характеристикам (SSCP) для устройств высокого риска и ежегодно обновлять ее. Документы SSCP будут доступны в базе данных медицинских устройств Европейского Союза (EUDAMED). Эта база данных, которая ранее была доступна только для регулирующих органов, теперь будет общедоступной и является важнейшим элементом новой системы. Однако работа по внедрению EUDAMED продвигается медленно, и неясно, будет ли общедоступный клинический интерфейс готов к маю 2020 г.
В-третьих, с точки зрения подотчетности каждое медицинское устройство должно быть идентифицируемо с помощью системы уникального идентификатора устройства (UDI). Больницы должны обеспечить наличие процессов для записи UDI каждого используемого устройства, чтобы облегчить быструю идентификацию затронутых пациентов в случае проблем, выявленных после продажи. Кроме того, всем пациентам должны быть выданы пропуска устройств с подробным описанием полученных устройств. Во многих странах эти изменения уже реализованы в полном объеме.
В-четвертых, будут повышены требования к послепродажному надзору. Это означает, что жизненный цикл медицинского изделия не завершен на момент утверждения или оценки соответствия. В соответствии с MDR производители несут повышенную ответственность за сбор пострегистрационных клинических данных и публикацию любых результатов в периодических обновленных отчетах о безопасности. Параллельно с этим должны существовать надежные процедуры бдительности, позволяющие собирать и выносить решения о неблагоприятных событиях, связанных с устройством, в клинической практике. В отношении обоих этих процессов решающую роль играют врачи в целом и кардиологи в частности. Как сообщество, мы должны обеспечить, чтобы производители и регулирующие органы сообщали о неблагоприятных событиях, связанных с устройствами высокого риска. Даже инциденты, которые кажутся относительно незначительными, могут иметь большее значение при объединении с другими отчетами. Кроме того, на врачей возложена важная обязанность по разработке и ведению клинических регистров или участию в них. Такие реестры способны выявлять важные неблагоприятные сигналы безопасности, как это было в случае с биорезорбируемыми каркасами. В то время как ранние рандомизированные клинические испытания не выявили признаков неблагоприятной безопасности8, ряд регистров, инициированных исследователями, выдвинули на первый план проблему тромбоза каркаса9 , 10, что впоследствии было подтверждено в крупномасштабных клинических испытаниях1. В то время как MDR четко возлагает ответственность за послепродажное наблюдение на производителей, мы, как врачи, должны осознавать потенциально важную роль независимого от отрасли сбора и анализа данных12.
В отношении обоих этих процессов решающую роль играют врачи в целом и кардиологи в частности. Как сообщество, мы должны обеспечить, чтобы производители и регулирующие органы сообщали о неблагоприятных событиях, связанных с устройствами высокого риска. Даже инциденты, которые кажутся относительно незначительными, могут иметь большее значение при объединении с другими отчетами. Кроме того, на врачей возложена важная обязанность по разработке и ведению клинических регистров или участию в них. Такие реестры способны выявлять важные неблагоприятные сигналы безопасности, как это было в случае с биорезорбируемыми каркасами. В то время как ранние рандомизированные клинические испытания не выявили признаков неблагоприятной безопасности8, ряд регистров, инициированных исследователями, выдвинули на первый план проблему тромбоза каркаса9 , 10, что впоследствии было подтверждено в крупномасштабных клинических испытаниях1. В то время как MDR четко возлагает ответственность за послепродажное наблюдение на производителей, мы, как врачи, должны осознавать потенциально важную роль независимого от отрасли сбора и анализа данных12.
Возможности для участия
Как уже говорилось, врачи играют центральную роль в пострегистрационном надзоре, участвуя в бдительности и в пострегистрационных клинических регистрах. Кроме того, при определенных обстоятельствах врачи также будут участвовать в предпродажной оценке. Это может быть связано с участием в клинических испытаниях, предназначенных для получения данных для утверждения устройства. В качестве альтернативы это может принимать форму участия в так называемых экспертных группах, которые вскоре будут введены в рамках MDR. Эти новые группы будут рассматривать досье документов, подготовленных уполномоченными органами для оценки конкретных устройств высокого риска (известных как отчеты об оценке клинической оценки), и решать, необходимо ли дополнительное исследование или нет. Позднее в этом году Европейская комиссия объявит о приглашении экспертов, готовых дать рекомендации по экспертным группам. Нагрузка на работу незначительна и может составлять до двух дней в месяц; компенсация комиссией предусмотрена. Критерии для участия в качестве эксперта будут опубликованы вместе с объявлением и будут включать требования, связанные с клиническим опытом и разрешением потенциальных конфликтов интересов.
Критерии для участия в качестве эксперта будут опубликованы вместе с объявлением и будут включать требования, связанные с клиническим опытом и разрешением потенциальных конфликтов интересов.
Новый MDR представляет собой важную веху в регулировании медицинских устройств в Европе. Многие из новых функций обещают повысить безопасность пациентов, получающих лечение с помощью имплантируемых устройств высокого риска. С другой стороны, существуют опасения относительно того, как будет осуществляться регулирование, поскольку конкретные ключевые инфраструктурные проекты, такие как база данных EUDAMED, еще не реализованы. Что несомненно, так это то, что роль врачей будет возрастать. Хотя все медицинские специальности будут затронуты в той или иной степени, наиболее полно, вероятно, будет затронута кардиология, особенно интервенционная кардиология. По этой причине мы обязаны быть в курсе происходящих изменений и как можно больше участвовать в новом регламенте.
Регламент Европейского Союза о медицинских изделиях – Регламент (ЕС) 2017/745 (EU MDR)
Ниже перечислены некоторые из самых последних публикаций, поддерживающих внедрение EU MDR.
Август 2022 г.:
- Публикация MDCG 2022-14 Переход к MDR и IVDR — Заявленная вместимость организма и наличие медицинских устройств и IVD.
- Публикация MDCG 2022-13 Назначение, повторная оценка и уведомление органов по оценке соответствия и нотифицированных органов.
Июнь 2022 г.:
- Публикация MDCG 2022-11 Документ с изложением позиции MDCG: уведомление производителей о своевременном соблюдении требований MDR.
Май 2022 г.:
- Публикация вопросов и ответов MDCG 2022-7 по уникальной системе идентификации устройств в соответствии с Регламентом (ЕС) 2017/745 и Регламентом (ЕС).
Апрель 2022 г.:
- Публикация MDCG 2022-5 Руководство по разграничению между медицинскими устройствами и лекарственными средствами в соответствии с Регламентом (ЕС) 2017/745 о медицинских устройствах.
- Публикация уведомления для заинтересованных сторон: Соглашение о Таможенном союзе между ЕС и Турцией в области медицинских устройств.

Март 2022 г.:
- Публикация (пересмотренная) MDCG 2019-9 Rev.1 Краткая информация о безопасности и клинической эффективности. Руководство для производителей и нотифицированных органов.
Февраль 2022 г.:
- Публикация MDCG 2022-4 Руководство по надлежащему надзору в отношении переходных положений статьи 120 MDR в отношении устройств, на которые распространяются сертификаты в соответствии с MDD или AIMDD.
Декабрь 2021 г.:
- Публикация Регламента (ЕС) 2021/2226 Комиссии (ЕС) 2021/2226 об электронных инструкциях по использованию медицинских устройств.
- Публикация MDCG 2021-28 Существенная модификация клинического исследования.
- Публикация MDCG 2021-27 Вопросы и ответы по статьям 13 и 14 (импортеры и дистрибьюторы).
Ноябрь 2021 г.:
- Публикация (ЕС) 2021/2078 Регламента Комиссии по реализации Европейской базы данных о медицинских устройствах (Eudamed).

Октябрь 2021 г.:
- Публикация MDCG 2021-26 Вопросы и ответы по переупаковке и перемаркировке в соответствии со статьей 16.
- Публикация MDCG 2021-25 Применение требований MDR к «устаревшим устройствам» и устройствам, выпущенным на рынок до 26 мая 2021 года.
- Публикация MDCG 2021-24 Руководство по классификации медицинских изделий.
- Модули EUDAMED UDI/Devices и NBs & Certificates теперь открыты для экономических операторов и нотифицированных органов.
Август 2021 г.:
- Публикация MDCG 2021-23 Руководство для уполномоченных органов, дистрибьюторов и импортеров по деятельности по сертификации в соответствии со Статьей 16(4).
Июль 2021 г.:
- Публикация MDCG 2021-20 Инструкции по созданию CIV-ID для клинических исследований MDR.
- Публикация MDCG 2021-19 Интеграция UDI в систему менеджмента качества организации.

- Публикация (пересмотр) MDCG 2021-13 Rev 1 Вопросы и ответы об обязательствах и соответствующих правилах регистрации в EUDAMED субъектов, не являющихся производителями, уполномоченными представителями и импортерами.
- Публикация первого мнения научных групп в области медицинских устройств
Июнь 2021 г.:
- Публикация первого мнения научных групп в области медицинских устройств
- Публикация MDCG 2021-13 Вопросы и ответы об обязательствах и соответствующих правилах регистрации в EUDAMED субъектов, не являющихся производителями, уполномоченными представителями и импортерами
- Публикация инфографики Европейской номенклатуры медицинских изделий (EMDN) – вопросы и ответы
- Публикация часто задаваемых вопросов MDCG 2021-12 по Европейской номенклатуре медицинских изделий (EMDN)
- Публикация руководства MDCG 2021-11 по карточке имплантатов «Типы устройств»
- Публикация Совместного плана реализации и готовности к IVDR
Май 2021 г. :
:
- Уведомление для заинтересованных сторон: Статус соглашения между ЕС и Швейцарией о взаимном признании медицинских устройств.
- Пресс-релиз от 26 мая 2021 г.: , объявляющий Вступили в силу более строгие правила в отношении медицинских устройств (EU MDR).
- Публикация MDCG 2021-8 Заявление/уведомление о клинических исследованиях.
- Служба поддержки UDI работает. Кликните сюда. Служба поддержки UDI предназначена для оказания помощи экономическим операторам в реализации требований новой системы UDI.
Апрель 2021 г.:
- Публикация MDCG 2021-6 Вопросы и ответы, касающиеся клинических исследований.
- Публикация MDCG 2021-5 Руководство по стандартизации медицинских изделий.
- Публикация MDCG 2021-4 Применение переходных положений для сертификации медицинских изделий класса D для диагностики in vitro (согласно Регламенту (ЕС) 2017/746).

- Обновление (пересмотр) MDCG 2018-1 Rev 4 Руководство по базовому UDI-DI и изменениям в UDI-DI.
- Публикация информационного бюллетеня о медицинских устройствах класса 1.
Март 2021 г.:
- Публикация MDCG 2021-3 Вопросы и ответы по изготовленным на заказ устройствам.
- Публикация MDCG 2021-2 Руководство по современным экспресс-тестам на антитела к COVID-19.
- Публикация инфографики «Является ли ваше программное обеспечение медицинским устройством?»
Февраль 2021 г.:
- Публикация MDCG 2021-1 Руководство по согласованным административным практикам и альтернативным техническим решениям, пока EUDAMED не станет полностью функциональным.
Декабрь 2020 г.:
- Публикация документа с изложением позиции MDCG 2020-18 по назначению UDI для очковых линз и готовых ридеров.
- Публикация обновления текущего руководства, разрабатываемого MDCG.

- Публикация обновленной информации о скользящем плане Комиссии по внедрению EU MDR и EU IVDR.
- Публикация MDCG 2020-17 Вопросы и ответы, связанные с руководством по аудиту нотифицированных органов во время COVID-19карантинные распоряжения и ограничения на поездки.
- Объявление Европейской комиссии о том, что модуль регистрации субъектов EUDAMED находится в производстве и доступен для государств-членов и экономических операторов.
Ноябрь 2020 г.:
- Публикация MDCG 2020-16 Руководства по правилам классификации медицинских изделий для диагностики in vitro в соответствии с Регламентом (ЕС) 2017/746.
Октябрь 2020 г.:
- Публикация процессов и процедур использования модуля регистрации EUDAMED (Актеры) с 1 декабря 2020 года.
Сентябрь 2020:
- Публикация MHRA Великобритании новых правил регулирования медицинских устройств с 1 января 2021 года в Великобритании и Северной Ирландии.

Август 2020 г.:
- Публикация Регламента Комиссии (ЕС) 2020/1207, содержащего общие спецификации для обработки одноразовых устройств.
- Публикация нового документа с изложением позиции MDCG: MDCG 2020-15, об использовании модуля регистрации субъектов EUDAMED и единого регистрационного номера (SRN) в государствах-членах ЕС.
- Публикация Комиссии ЕС по системе уникальной идентификации устройств (UDI) — часто задаваемые вопросы.
- Публикация нового руководства MDCG для нотифицированных органов: MDCG 2020-14, использование аудиторских отчетов MDSAP в надзорных аудитах, проводимых в соответствии с MDR/IVDR.
июль 2020 г.:
- Публикация нового руководства MDCG для нотифицированных органов: MDCG 2020-13, шаблон отчета об оценке клинической оценки производителя.
Июнь 2020:
- Публикация нового руководства MDCG для нотифицированных органов: MDCG 2020-12, переходные (от MDD/AIMD к MDR) меры для консультаций с органами по лекарственным средствам.

Май 2020:
- Публикация обновления формы Отчета производителя о происшествиях (МИР) за 2020 год, новая версия 7.2.1 вместе с документом «Вопросы и ответы» по внедрению.
- Публикация нового руководства MDCG: MDCG 2020-10/1 «Отчетность по безопасности в клинических исследованиях» вместе с MDCG 2020-10/2 «Форма краткого отчета о безопасности клинических исследований».
Апрель 2020: Публикация в Официальном журнале Европейского союза Регламента (ЕС) 2020/561, изменяющего дату применения Регламента (ЕС) 2017/745 с 26 мая 2020 г. по 26 мая 2021 г.
Апрель 2020:
- Публикация двух новых руководящих документов MDCG: Шаблон плана послепродажного клинического наблюдения (PMCF) MDCG 2020-7 и Шаблон отчета об оценке MDCG 2020-8 Послепродажного клинического наблюдения (PMCF).
- Публикация двух новых руководящих документов MDCG: MDCG 2020-5 «Клиническая оценка — эквивалентность» и MDCG 2020-6 «Клинические данные, необходимые для медицинских устройств, ранее отмеченных знаком CE в соответствии с Директивами 93/42/EEC или 90/385/EEC».

Март 2020:
- 25 марта 2020 года Комиссия объявила о предложении перенести дату подачи заявки на Регламент о медицинских устройствах (MDR) на один год.
- Публикация трех новых руководящих документов MDCG: MDCG 2020-1 о клинической оценке/оценке производительности программного обеспечения для медицинских устройств, MDCG 2020-2, класс I, переходные положения, MDCG 2020-3 о существенных изменениях в соответствии со статьей 120.
- Публикация изменений к двум более ранним руководящим документам MDCG: MDCG 2018-1 v3 по BASIC UDI-DI и изменениям к UDI-DI и MDCG 2019-8 v2 на картах имплантатов.
- Публикация совместных приоритетов и действий Комиссии и государств-членов, которые должны быть завершены до мая 2020 года.
Январь 2020 г.:
- Публикация Европейской номенклатуры медицинских изделий, необходимая для EUDAMED в соответствии со статьей 26.
- Европейская комиссия опубликовала MDCG 2019-16: Руководство по кибербезопасности для медицинских устройств.

Декабрь м ber 2019:
- В Официальном журнале Европейского Союза опубликовано второе исправление к Регламенту (ЕС) 2017/745. Вероятно, наиболее значительным изменением является расширение переходных положений статьи 120(3) для включения устаревших (MDD) устройств класса 1, для которых требуется сертификат нотифицированного органа в соответствии с EU MDR.
- Европейская комиссия опубликовала MDCG 2019-15: Руководящие указания для производителей медицинских изделий класса I.
Nove m ber 2019:
- Компетентные органы по медицинским изделиям (CAMD) опубликовали письмо в ответ на объявленную задержку в EUDAMED. Нажмите здесь, чтобы прочитать письмо на сайте CAMD.
Октябрь 2019 г.:
- Европейская комиссия опубликовала следующее заявление о запуске EUDAMED: «Комиссия пришла к выводу, что ввести EUDAMED в эксплуатацию можно будет только после того, как вся система и ее различные модули достигнут полной функциональности.
 и прошли независимую проверку. Поэтому запуск EUDAMED будет осуществлен одновременно для медицинских устройств и медицинских устройств in-vitro в первоначальную дату, предусмотренную для медицинских устройств in-vitro, то есть в мае 2022 года». Нажмите здесь, чтобы перейти на страницу EUDAMED Комиссии.
и прошли независимую проверку. Поэтому запуск EUDAMED будет осуществлен одновременно для медицинских устройств и медицинских устройств in-vitro в первоначальную дату, предусмотренную для медицинских устройств in-vitro, то есть в мае 2022 года». Нажмите здесь, чтобы перейти на страницу EUDAMED Комиссии. - Европейская комиссия опубликовала MDCG 2019-11, Руководство по квалификации и классификации программного обеспечения в Регламенте (ЕС) 2017/745 — MDR.
Август 2019:
- Европейская комиссия опубликовала MDCG 2019-9, Руководство для производителей и уполномоченных органов по Краткому обзору безопасности и клинических характеристик (SSCP).
- Европейская комиссия опубликовала ответы на часто задаваемые вопросы (FAQ) о системе уникальной идентификации устройств (UDI).
Июнь 2019 г. :
- Европейская комиссия опубликовала MDCG 2019-8, руководство по формату карты имплантации, которая должна предоставляться пациентам.

- Европейская комиссия опубликовала MDCG 2019-7, руководство по лицу, ответственному за соблюдение нормативных требований (PRRC).
- Европейская комиссия опубликовала ИСПОЛНИТЕЛЬНОЕ РЕШЕНИЕ (ЕС) 2019/939, назначив четыре организации для присвоения уникальных идентификаторов устройств (UDI) медицинским устройствам для европейского рынка.
- Европейское агентство по лекарственным средствам (EMA) опубликовало проект руководства и начало консультации по реализации статьи 117 MDR ЕС, касающейся комбинаций лекарств и устройств.
Май 2019 г.:
- Было опубликовано несколько технических документов EUDAMED, в том числе; словарь данных, наборы данных MDR и IVDR, обновление руководства 2018-1 по базовому UDI и изменениям, введение в электронный обмен данными, определения и рекомендации.
- Исправление (список ошибок) к EU MDR было опубликовано в Официальном журнале Европейского Союза от 5 мая 2017 года. Все выявленные ошибки незначительны: в основном отдельные слова, измененные для обеспечения большей согласованности в толковании, или исправления ошибок в перекрестных ссылках внутри регламента.

Апрель 2019:
Координационная группа по медицинскому оборудованию (MDCG) утвердила еще два документа, уточняющих сроки и требования для использования базы данных EUDAMED:
- Документ 2019-4 подтверждает крайний срок регистрации сведений об устройстве в EUDAMED (Приложение VI, часть A, раздел 2 и часть B) будет либо; (a) через 18 месяцев после даты подачи заявки в мае 2020 года, если EUDAMED уже считается (по результатам независимого аудита) полностью функциональным в срок. Или (b) через 24 месяца после даты, когда EUDAMED считается полностью функциональным.
- Документ 2019-5 подтверждает, что так называемые устаревшие устройства (поступившие на рынок после мая 2020 года на основе сертификата MDD) не требуют для регистрации ни базового UDI-DI, ни UDI-DI.
Март 2019 г.:
- Комиссия ЕС опубликовала Функциональную спецификацию для базы данных EUDAMED, включая план реализации проекта, как того требует статья 34 Регламента.

Ноябрь 2018 г.:
- Комиссия ЕС опубликовала обновленные версии своего информационного бюллетеня для производителей медицинских устройств и модели реализации Регламента о медицинских устройствах — пошаговое руководство.
- Комиссия ЕС опубликовала три новых информационных бюллетеня, описывающих последствия новых Правил для различных заинтересованных сторон: (1) информационный бюллетень для уполномоченных представителей, импортеров и дистрибьюторов, (2) информационный бюллетень для лиц, участвующих в закупках медицинских устройств и IVD, (3) информационный бюллетень для органов власти в государствах, не входящих в ЕС/ЕЭЗ.
- Комиссия ЕС опубликовала новую инфографику, иллюстрирующую сроки перехода от Директив к Регламентам.
Октябрь 2018 г.:
- Комиссия ЕС опубликовала круг ведения 11 рабочих групп, созданных для поддержки ЦРТ путем подготовки руководства по; Уполномоченный орган по надзору, стандарты, клинические исследования и оценка, пострыночный надзор и бдительность, надзор за рынком, границы и классификация, новые технологии, UDI, IVD, международные вопросы.

- Комиссия ЕС опубликовала обновленный отчет о совместных оценках нотифицированных органов в секторе медицинского оборудования.
- Комиссия ЕС опубликовала свой текущий скользящий план мер по реализации MDR и IVDR, который включает список исполнительных актов, подлежащих публикации.
- Пять новых руководств и спецификаций, относящихся к новой системе UDI, были опубликованы на сайте Комиссии ЕС в разделе MDCG Documents.
- Опубликована повестка дня октябрьского совещания Координационной группы по медицинскому оборудованию.
Сентябрь 2018 г.:
- Повестка дня сентябрьского совещания Координационной группы по медицинскому оборудованию (MDCG) была опубликована вместе с повесткой дня совещания, проведенного между MDCG и заинтересованными сторонами, включая представителей отрасли.
Июль 2018 г.:
- Три новых документа, опубликованных Комиссией ЕС: Информационный бюллетень для производителей медицинских устройств и Пошаговая модель внедрения, а также Исчерпывающий список требований к производителям медицинских устройств.

- Опубликована повестка дня июльского совещания Координационной группы по медицинскому оборудованию.
Июнь 2018 г.:
- Комиссия ЕС опубликовала информацию о ходе совместных оценок нотифицированных органов в секторе медицинского оборудования.
Май 2018 г.:
- Опубликованы повестка дня и протокол майского заседания Координационной группы по изделиям медицинского назначения.
Апрель 2018:
- После одобрения MDCG в марте были опубликованы первые новые документы, касающиеся европейского UDI; два руководящих документа и два документа с определениями. Они были опубликованы на странице руководства Комиссии по медицинским устройствам в новом подразделе под названием «Документы MDCG».
Март 2018 г.:
- Координационная группа по медицинскому оборудованию (MDCG) провела свое второе совещание. Хотя сами собрания закрыты для публики, повестка дня и протоколы находятся в открытом доступе.

- Европейский комитет по стандартизации (CEN) опубликовал CEN/TR 17223:2018 Руководство по взаимосвязи между EN ISO 13485: 2016 (Медицинские изделия. Системы управления качеством. Требования для целей регулирования) и Европейским регламентом по медицинским изделиям и диагностическим медицинским оборудованием In Vitro. Положение об устройствах.
Февраль 2018 г.:
- Публикация повестки дня и протокола первого собрания Координационной группы по медицинскому оборудованию (MDCG), которое состоялось в ноябре 2017 г. Темы повестки дня включали текущее состояние дел Eudamed, UDI и имплементационные акты.
Январь 2018 г.:
- Компетентные органы ЕС по медицинским изделиям (CAMD) также опубликовали часто задаваемые вопросы, посвященные переходным механизмам: от MDD к MDR и от IVDD к IVDR.
- В настоящее время создана Координационная группа по медицинскому оборудованию (MDCG), на которую возложены многие обязанности в соответствии с новым Регламентом.
 Внесен в реестр экспертных групп Комиссии под номером X03565. Его миссия включает «обеспечение согласованного выполнения» новых Правил. >>> нажмите здесь <<<
Внесен в реестр экспертных групп Комиссии под номером X03565. Его миссия включает «обеспечение согласованного выполнения» новых Правил. >>> нажмите здесь <<< - Комиссия ЕС опубликовала «Уведомление для заинтересованных сторон» о последствиях выхода Великобритании из ЕС, которое полностью проясняет ситуацию. Как говорится в Уведомлении: «все первичные и вторичные законы Союза перестанут применяться в Соединенном Королевстве с 30 марта 2019 года, 00:00 (центрально-европейское время) («дата отзыва»). После этого Великобритания станет «третьей страной». Это означает, что если между Великобританией и ЕС не будет заключено специальное соглашение до 30 марта 2019 года, британская компания не может выступать в качестве уполномоченного органа, уполномоченного представителя или импортера в соответствии с новым Регламентом (или в соответствии с действующей Директивой). >>> нажмите здесь <<<
Ноябрь 2017 г.:
- Компетентные органы ЕС по медицинским изделиям (CAMD) опубликовали первую общедоступную версию «дорожной карты» для разработки подробных нормативных руководящих документов, необходимых для поддержки внедрения ЕС.
 МЛУ и EU IVDR. Хотя эта дорожная карта первой версии не содержит временных рамок, в ней указывается приоритет, отдаваемый соответствующим документам. >>> нажмите здесь <<<
МЛУ и EU IVDR. Хотя эта дорожная карта первой версии не содержит временных рамок, в ней указывается приоритет, отдаваемый соответствующим документам. >>> нажмите здесь <<< - Европейская комиссия опубликовала первый имплементационный регламент, касающийся MDR ЕС и IVDR ЕС, в Официальном журнале ЕС. Регламент (ЕС) 2017/2185 содержит коды и соответствующие типы устройств, которые должны использоваться для определения области назначений уполномоченных органов. >>> нажмите здесь <<<
- Операционная группа уполномоченных органов (NBOG) опубликовала на своем веб-сайте несколько новых документов, связанных с EU MDR и EU IVDR. Они включают в себя руководство по передовой практике процесса (повторного) назначения и уведомления, а также дополнительные формы, которые должны быть представлены уполномоченным органом-заявителем. >>> нажмите здесь <<<
Октябрь 2017 г.:
- Поскольку Швейцария не является членом ЕС или ЕЭЗ, новые правила ЕС не являются там законом.
 В октябре 2017 года швейцарский парламент принял временный закон (Medizinprodukteverordnung (MepV)), который позволяет нотифицированным органам-кандидатам, базирующимся в Швейцарии, подавать в Swissmedic заявки на назначение в соответствии с новыми правилами ЕС. Это также позволяет Swissmedic назначать экспертов в новую Координационную группу по медицинскому оборудованию ЕС (MDGC). Однако швейцарские версии новых правил ЕС по MDR и IVDR все еще находятся в стадии разработки. >>> нажмите здесь <<<
В октябре 2017 года швейцарский парламент принял временный закон (Medizinprodukteverordnung (MepV)), который позволяет нотифицированным органам-кандидатам, базирующимся в Швейцарии, подавать в Swissmedic заявки на назначение в соответствии с новыми правилами ЕС. Это также позволяет Swissmedic назначать экспертов в новую Координационную группу по медицинскому оборудованию ЕС (MDGC). Однако швейцарские версии новых правил ЕС по MDR и IVDR все еще находятся в стадии разработки. >>> нажмите здесь <<<
Эластография при оценке сигнальных лимфатических узлов перед диссекцией
. 2012 ноябрь;81(11):3154-9.
doi: 10.1016/j.ejrad.2012.04.031. Epub 2012 30 мая.
Кристоф Турасс 1 , Жан-Франсуа Денье, Аззам Авада, Анн-Кристель Гратадур, Карима Несса-Буске, Жоэль Гей
Принадлежности
принадлежность
- 1 Рентгенологическое отделение частной больницы Жана Мермо, 55 авеню Жан Мермоз, 69008 Лион, Франция.
 [email protected]
[email protected]
- PMID: 22656671
- DOI: 10.1016/j.ejrad.2012.04.031
Кристоф Турасс и др. Евр Дж Радиол. 2012 ноябрь
. 2012 ноябрь;81(11):3154-9.
doi: 10.1016/j.ejrad.2012.04.031. Epub 2012 30 мая.
Авторы
Кристоф Турасс 1 , Жан-Франсуа Денье, Аззам Авада, Анн-Кристель Гратадур, Карима Несса-Буске, Жоэль Гей
принадлежность
- 1 Рентгенологическое отделение частной больницы Жана Мермо, 55 авеню Жан Мермоз, 69008 Лион, Франция.
 [email protected]
[email protected]
- PMID: 22656671
- DOI: 10.1016/j.ejrad.2012.04.031
Абстрактный
Задача: Рак молочной железы начинается как локальная опухоль, но может стать метастатическим и распространиться через лимфатические узлы. Когда предоперационная оценка подмышечных лимфатических узлов является отрицательной, пациентам обычно проводят биопсию сигнального узла (SNB), а затем вторичную хирургическую диссекцию подмышечных лимфатических узлов (ALND), если SNB положительный. Экстемпоральный анатомо-патологический анализ сторожевого лимфатического узла позволяет выявить метастазы и ALND одновременно с SNB. Цель этого исследования состояла в том, чтобы оценить дополнительную ценность эластографии ShearWave (SWE) по сравнению с обычной предоперационной оценкой при скрининге сигнальных лимфатических узлов с высоким риском метастазирования, которые затем могли бы выиграть от экстемпоральной анатомо-патологической анализ.
Цель этого исследования состояла в том, чтобы оценить дополнительную ценность эластографии ShearWave (SWE) по сравнению с обычной предоперационной оценкой при скрининге сигнальных лимфатических узлов с высоким риском метастазирования, которые затем могли бы выиграть от экстемпоральной анатомо-патологической анализ.
Пациенты и методы: Женщины, перенесшие операцию на груди с SNB, были включены проспективно. Перед операцией они прошли ультразвуковое исследование и эластографию подмышечных лимфатических узлов с использованием устройства SuperSonic Imagine и режима эластографии ShearWave™ (SWE™). Полученные результаты сравнивали с результатами иммуногистохимии удаленных лимфатических узлов.
Полученные результаты: Было зарегистрировано 65 пациентов. Из 103 лимфатических узлов, исследованных с помощью эластографии, и 185 удаленных лимфатических узлов мы смогли спарить 81; 70 были здоровыми и 11 злокачественными. Измерения жесткости (средние и максимальные значения) значительно различались между здоровыми и метастатическими лимфатическими узлами (p<0,05). Площади под ROC-кривыми составляли 0,76 (95% доверительный интервал (ДИ): 0,58–0,94) и 0,75 (95% ДИ: 0,55–0,95) для средней и максимальной жесткости соответственно.
Измерения жесткости (средние и максимальные значения) значительно различались между здоровыми и метастатическими лимфатическими узлами (p<0,05). Площади под ROC-кривыми составляли 0,76 (95% доверительный интервал (ДИ): 0,58–0,94) и 0,75 (95% ДИ: 0,55–0,95) для средней и максимальной жесткости соответственно.
Вывод: Эти обнадеживающие результаты показывают корреляцию между риском метастазирования лимфатических узлов и их повышенной средней жесткостью. Были определены переменные эластичности и потенциальные пороги, которые, по-видимому, предсказывают метастатический статус подмышечных лимфатических узлов. Если эти результаты будут подтверждены дальнейшими более крупными исследованиями, эти результаты могут быть полезны в клинической практике для выявления лимфатических узлов с высоким риском метастазирования, для которых можно было бы использовать интраоперационный анализ для уменьшения количества вторичных хирургических вмешательств.
Copyright © 2012 Elsevier Ireland Ltd. Все права защищены.
Похожие статьи
Биопсия сигнального лимфатического узла по сравнению с забором образцов из нижней подмышечной впадины у женщин с клинически отрицательным операбельным раком молочной железы.
Пармар В., Хавалдар Р., Наир Н.С., Шет Т., Ванмали В., Десаи С., Гупта С., Ранграджан В., Миттра И., Бадве Р.А. Пармар В. и др. Грудь. 2013 Декабрь; 22 (6): 1081-6. doi: 10.1016/j.breast.2013.06.006. Epub 2013 13 августа. Грудь. 2013. PMID: 23948301 Клиническое испытание.
Компрессионная эластография аномальных подмышечных лимфоузлов у больных раком молочной железы не повышает точность диагностики по сравнению с обычным ультразвуковым исследованием.

Парк Ю.М., Форнаж Б.Д., Бенвенист А.П., Фокс П.С., Бассет Р.Л. младший, Ян В.Т. Парк Ю.М. и др. AJR Am J Рентгенол. 2014 декабрь; 203(6):1371-8. дои: 10.2214/AJR.13.12349. AJR Am J Рентгенол. 2014. PMID: 25415717
Предоперационная оценка состояния подмышечных лимфатических узлов у пациентов с подозрением на рак молочной железы с использованием эластографии сдвиговой волны.
Юк Дж. Х., Сон Э. Дж., Ким Дж. А., Гвон Х. М. Юк Дж. Х. и соавт. Ультразвук Медицина Биол. 2017 авг; 43 (8): 1581-1586. doi: 10.1016/j.ultrasmedbio.2017.03.016. Эпаб 2017 13 мая. Ультразвук Медицина Биол. 2017. PMID: 28511961
Сигнальный лимфатический узел как новый маркер для терапевтического планирования у больных раком молочной железы.

Гиппони М., Бассетти К., Канавезе Г., Каттурих А., Ди Сомма К., Веккьо К., Николо Г., Шеноне Ф., Томей Д., Кафьеро Ф. Гиппони М. и др. Дж. Хирург Онкол. 2004 март; 85(3):102-11. doi: 10.1002/jso.20022. Дж. Хирург Онкол. 2004. PMID: 149 Обзор.
Стадирование женщин с раком молочной железы после введения подмышечной диссекции под контролем сторожевого узла.
Тведсков ТФ. Тведсков ТФ. Dan Med J. 2012 г., июль; 59 (7): B4475. Дэн Мед Дж. 2012. PMID: 22759850 Обзор.
Посмотреть все похожие статьи
Цитируется
Эффективность количественной эластографии сдвиговой волны для прогнозирования метастазов в подмышечных лимфатических узлах.

Ченг Ю, Ли Г, Цзин Х, Юань С, Чжан Л, Ченг В. Ченг Ю и др. Комплемент на основе Evid Alternat Med. 2022 28 июня; 2022:8769889. Дои: 10.1155/2022/8769889. Электронная коллекция 2022. Комплемент на основе Evid Alternat Med. 2022. PMID: 35800003 Бесплатная статья ЧВК.
Прогнозирование высокой узловой нагрузки при инвазивном раке молочной железы с помощью количественной эластографии сдвиговой волны.
Ли Б., Чжао С., Ван Ц., Цзин Х., Шао Х., Чжан Л., Ченг В. Ли Б и др. Quant Imaging Med Surg. 2022 Февраль;12(2):1336-1347. doi: 10.21037/qims-21-580. Quant Imaging Med Surg. 2022. PMID: 35111628 Бесплатная статья ЧВК.
Диагностическая эффективность количественной и качественной эластографии при метастазах в подмышечные лимфатические узлы при раке молочной железы: систематический обзор и метаанализ.

Хуан С.В., Хуан К.С., Хуан Х., Ченг М.К., Тонг В.Дж., Сиань М.Ф., Лян Д.И., Ван В. Хуанг XW и др. Фронт Онкол. 2020 15 окт;10:552177. doi: 10.3389/fonc.2020.552177. Электронная коллекция 2020. Фронт Онкол. 2020. PMID: 33178580 Бесплатная статья ЧВК.
Прогностическая ценность ультразвуковой сдвиговой эластографии с расческой и толчком для дифференциации реактивных и метастатических подмышечных лимфатических узлов: предварительное исследование.
Грегори А., Денис М., Баят М., Кумар В., Ким Б.Х., Уэбб Дж., Наяк Р., Адаби С., Мейкснер Д.Д., Полли Э.К., Фаццио Р.Т., Фатеми М., Ализад А. Грегори А. и др. ПЛОС Один. 2020 13 января; 15 (1): e0226994. doi: 10.1371/journal.pone.0226994. Электронная коллекция 2020. ПЛОС Один. 2020. PMID: 31929558 Бесплатная статья ЧВК.
Номограмма, построенная с помощью интраоперационной эластографии поперечной волны ex vivo, точно предсказывает метастазирование сигнальных лимфатических узлов при раке молочной железы.

Bae SJ, Youk JH, Yoon CI, Park S, Cha CH, Lee HW, Ahn SG, Lee SA, Son EJ, Jeong J. Bae SJ и др. Евро Радиол. 2020 февраля; 30 (2): 789-797. doi: 10.1007/s00330-019-06473-5. Epub 2019 6 ноября. Евро Радиол. 2020. PMID: 31696293 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
- Конференция
- {{Заголовок}}
- Северная и Южная Америка
- {{Заголовок}}
- Обзор
- Повестка дня
- Компьютерные колонки
- Дополнительная информация
- Путешествовать
- Регистрационные сборы
- Выставка и спонсорство
- Связанные события
- Контакт
1 день
День 2
Плакаты
- ВТОРНИК, 18 ОКТЯБРЯ
08:00 – 10:00 | P1: Ускоренная разработка вакцин и преимущества платформ
Модератор: Матиас Ромакер, Исполнительный советник, KymanoxНа этом вступительном пленарном заседании представлены основные доклады двух старших руководителей биофармацевтических компаний.
 В первой презентации д-р Джон Людвиг расскажет аудитории об удивительном путешествии Pfizer по разработке вакцины против COVID-19. Как это было сделано, каковы были препятствия, уроки и как это можно было сделать так быстро? Спикер завершит дискуссию о том, как применять парадигмы скорости света для будущих успехов. После этого д-р Рональд Форстер из Amgen расскажет о преимуществах разработки платформенных технологий и о том, как они обеспечивают постоянное улучшение пути пациента за счет качества продукции, инноваций и эффективности производства. Доктор Форстер также подробно расскажет о том, как использовать идеи, полученные из других отраслей.
В первой презентации д-р Джон Людвиг расскажет аудитории об удивительном путешествии Pfizer по разработке вакцины против COVID-19. Как это было сделано, каковы были препятствия, уроки и как это можно было сделать так быстро? Спикер завершит дискуссию о том, как применять парадигмы скорости света для будущих успехов. После этого д-р Рональд Форстер из Amgen расскажет о преимуществах разработки платформенных технологий и о том, как они обеспечивают постоянное улучшение пути пациента за счет качества продукции, инноваций и эффективности производства. Доктор Форстер также подробно расскажет о том, как использовать идеи, полученные из других отраслей.08:00 | Вступительное слово сопредседателей конференции и вручение наград
Джеффри Живанд, доктор философии, сопредседатель, КПК Вселенная конференции предварительно заполненных шприцев и инъекционных устройств и исполнительный директор по разработке устройств и комбинированных продуктов, Merck & Co. , Inc.
, Inc.
Матиас Ромакер, Сопредседатель, Конференция PDA Universe of Pre-filled Syrings and Injections Devices и исполнительный советник, Kymanox08:30 | История разработки вакцины против COVID-19
John D. Ludwig, PhD, Старший вице-президент по медицинским наукам, Pfizer09:00 | Комбинированный подход к платформе продуктов и устройств
09:30 | Вопросы и ответы
Рональд Форстер, доктор философии, Исполнительный директор, Amgen10:00 – 10:45 | Перерыв на закуску, технические переговоры, и постерные презентации в выставочном зале
10:45 – 12:15 | P2: Уроки эффективного партнерства по разработке лекарств и устройств
Модератор: Джеффри Живанд, доктор медицинских наук, Исполнительный директор по разработке устройств и комбинированных продуктов, Merck & Co. , Inc.
, Inc. Успешная разработка и коммерциализация комбинированных продуктов требует надежных партнерских отношений между поставщиками фармацевтических препаратов, устройств и компонентов. Глубокое понимание как способностей, так и ограничений каждого члена партнерства имеет решающее значение для составления плана развития, ориентированного на успех. Выступающие на этом пленарном заседании расскажут о проблемах и успехах со всех точек зрения партнерства. Будут открыто обсуждаться ключевые выводы и передовой опыт в области партнерства.
10:45 | Производители устройств и лекарств идут одним путем: совместный подход к разработке комбинированного продукта
Грегг Петерсон, Массачусетс, Генеральный директор, Bexson Biomedical
Стивен Р. Кауфман, MBA, Вице-президент по системам доставки лекарств, Группа Стеванато11:15 | Межотраслевое сотрудничество как средство быстрой и успешной разработки новых инъекционных устройств: пример использования патч-инъектора
11:45 | Вопросы и ответы
Рето Йост, магистр наук, Директор по инновациям и развитию бизнеса, Ypsomed AG12:15 – 13:30 | Деловой обед и технические переговоры в выставочном зале
13:30 – 15:00 | Параллельные сеансы
A1: Подключенные устройства и цифровые экосистемы
Стремясь продолжить наше путешествие и понять эволюцию и проблемы цифрового здравоохранения и подключенных устройств, эта сессия будет посвящена нескольким ключевым областям: как проектировать и развивать цифровые экосистемы, ориентированные на пользователя, способные стимулировать приверженность и соблюдение пациентами; как интегрировать подключение в устройство и свести к минимуму проблемы безопасности и другие проблемы, связанные с взаимодействием с пользователем. Будут представлены реальные кейсы о том, как разрабатывать коммерчески успешные подключенные продукты.
Модератор: Акшай Р. Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company
Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company 13:30 | Семь ключевых столпов успешной разработки подключенных инъекционных устройств
Пол Дрейпер, MEng, Старший менеджер сектора медицины и науки, DCA Design International13:50 | Разработка цифрового объемного звучания для подключенных устройств: практический пример
Грэм Б. Джонс, PhD, DSc, Руководитель отдела исследований и инноваций, Novartis International AG
Джонс, PhD, DSc, Руководитель отдела исследований и инноваций, Novartis International AG
Марти Койн, BEME, MBA, Директор, Matchstick LLC14:10 | Интеграция безопасного и удобного подключения в предварительно заполненное устройство для автоматической регистрации инъекций
14:30 | Вопросы и ответы
Стефан Мангольд, доктор философии, Менеджер по разработке концепции, Ypsomed AGB1: Проблемы и возможности переноса лечения в домашнюю обстановку
Модератор: Джош Гонсалес, Главный коммерческий директор, SHL MedicalВ связи с тем, что методы лечения переходят от клиники к домашнему применению, возникает множество проблем, связанных с тем, чтобы сделать эту практику общепринятой.
 Тенденция к перемещению терапии в домашних условиях была известна в течение некоторого времени, но пандемия ускорила и изменила стратегии разработки лекарств. На этом занятии будут рассмотрены различные возможности для того, чтобы сделать доставку лекарств на дому реальностью — от интеллектуальных устройств доставки для домашних условий, позволяющих использовать первичные контейнеры для одноразового использования, до обучения пациентов и бортовых решений, специально разработанных для домашнего использования.
Тенденция к перемещению терапии в домашних условиях была известна в течение некоторого времени, но пандемия ускорила и изменила стратегии разработки лекарств. На этом занятии будут рассмотрены различные возможности для того, чтобы сделать доставку лекарств на дому реальностью — от интеллектуальных устройств доставки для домашних условий, позволяющих использовать первичные контейнеры для одноразового использования, до обучения пациентов и бортовых решений, специально разработанных для домашнего использования.13:30 | Перспективы, проблемы и рекомендации по разработке интеллектуальных инъекционных препаратов для клинических и коммерческих операций
Амин Седигиамири, доктор философии, Заместитель директора, AstraZeneca13:50 | Решение проблем с первичным контейнером при доставке лекарств с помощью автоинжектора: промежуточные результаты многофазного исследования бионагрузки для автоинъектора на основе картриджа
Эми Хартл, доктор философии, Директор по развитию процессов, SHL Medical
Лорен Гимонд, MS, Менеджер по аналитическим наукам, SHL Medical14:10 | Перенос обучения пациентов с клинических на домашние условия
14:30 | Вопросы и ответы
Тим Маклерой, Исполнительный директор отдела маркетинга и обслуживания пациентов, Noble InternationalC1: Новые технологии и подходы в производстве
На этом занятии участники сначала рассмотрят первичные упаковочные материалы, чтобы узнать, как будут вести себя иглы и есть ли у препарата склонность к быстрому высыханию. Это будет включать в себя углубленную статистическую оценку. Затем будут представлены наиболее важные параметры асептического розлива (обеспечения стерильности) на полностью автоматизированной линии, после чего будет предложена наилучшая организация сотрудничества между партнерами для успешного запуска продукта.
Модератор: Манфред Маедер, Головное устройство Dev. и коммерциализация, разработка/коммерциализация устройств, Novartis International AG
и коммерциализация, разработка/коммерциализация устройств, Novartis International AG 13:30 | Использование анализа Вейбулла для оценки времени засорения иглы в предварительно наполненных шприцах, наполненных быстросохнущим лекарственным средством
Линн Ляо, Старший инженер I, Alexion Pharmaceuticals13:50 | Достижения в области полностью роботизированных бесконтактных решений, используемых для введения RTU-контейнеров в асептические изоляторы, улучшения контроля загрязнения и обеспечения стерильности
Габриэле Рустичи Вентурини, магистр наук, Инженер-исследователь-конструктор-механик, IMA Life14:10 | Выбор партнеров-производителей и сотрудничество с ними для успешного запуска продукта
14:30| Вопросы и ответы
Крис Хёрлстоун, Массачусетс, Технический директор, Team Consulting15:00 – 15:45 | Перерыв, технические переговоры и стендовые доклады в выставочном зале
15:45 – 17:15 | Параллельные сеансы
A2: Цифровые решения для здравоохранения: фокус на конечного пользователя
Мы постоянно стремимся внедрять персонализированные, ориентированные на пользователя (пациента) цифровые решения для здравоохранения, чтобы улучшить внедрение терапии, приверженность и результаты. Это требует комплексного подхода, включающего знания в области науки о поведении, разработки аппаратного и программного обеспечения, анализа данных, экономики здравоохранения и исследований результатов (HEOR), нормативных требований и требований к конфиденциальности и многого другого. На этом заседании докладчики обсудят, как справиться со сложностями разработки решений для цифрового здравоохранения, не забывая при этом о конечном пользователе.
Модератор: Тереза Э. Бэнкстон, доктор философии, вице-президент по работе с клиентами, BD
Бэнкстон, доктор философии, вице-президент по работе с клиентами, BD 15:45 | Цифровое здравоохранение при доставке лекарств: основа аппаратного и программного обеспечения для расширения возможностей конечного пользователя
16:05 | Основанная на фактических данных разработка цифровых медицинских решений, направленных на повышение вовлеченности пациентов
Андреа М. Пиза, MSc, MA, Руководитель отдела человеческого фактора, Crux Product Design Ltd
Пиза, MSc, MA, Руководитель отдела человеческого фактора, Crux Product Design Ltd 16:25 | Переосмысление взаимодействия: цикл данных и инноваций
16:45 | Вопросы и ответы
Ури Барух, MEng, Партнер и руководитель отдела доставки лекарств, Cambridge Design PartnershipB2: Глубокое холодильное хранение: как повысить целостность и стабильность
Как недавно столкнулись во время пандемии с мРНК-вакцинами, а также с другими видами лечения, некоторые лекарственные препараты потребуют хранения конечного контейнера в глубоком холодильнике по соображениям стабильности. Для этих применений CCI и стабильность лекарственного препарата остаются большими проблемами.
Модератор: Лоран Жанмар, доктор философии, Руководитель отдела упаковки и медицинских устройств, GSK На этом занятии докладчики опишут различные подходы к улучшению и контролю взаимодействия CCI и контейнеров с лекарствами в течение срока годности при низких температурах.
На этом занятии докладчики опишут различные подходы к улучшению и контролю взаимодействия CCI и контейнеров с лекарствами в течение срока годности при низких температурах.15:45 | Гибридные предварительно наполненные шприцы, пригодные для холодного хранения вакцин и биологических препаратов без ущерба для герметичности контейнера
16:05 | Раздвигая границы для предварительно наполненных стеклянных шприцев: герметичность крышки контейнера, стабильность и эффективность при -80°C
Углеша Бабич, Младший руководитель проекта, Schott Schweiz AG16:25 | Оценка целостности крышки предварительно заполненного контейнера шприца в условиях глубокого холодного хранения с использованием комбинации прогнозного моделирования и эмпирических испытаний
16:45 | Вопросы и ответы
Дункан Патерсон, MSc, MBA, Старший директор по разработке устройств, AstraZeneca 9009 9009 88820- 0
0 9009
Джереми Хемингуэй, MS, физкультура, 9 лет0081 Старший юрист, Stress Engineering Services, Inc.
C2: Инструменты и подходы для повышения устойчивости устройств и цепочки их поставок
На этом заседании будет рассмотрена устойчивость устройств доставки лекарств по всей цепочке поставок. Он намерен предоставить обновленную информацию о полезных инструментах, а также примеры инновационных отраслевых подходов к снижению воздействия на окружающую среду комбинированных продуктов и устройств для доставки лекарств за счет оптимизации конструкции устройств, упаковки и цепочки поставок.
Модератор: Якоб Ланге, доктор философии, Старший директор по системам доставки, Ypsomed AG15:45 | Интеграция устойчивого развития в устройства и упаковочные продукты: стратегии и возможности
Акшай Р. Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company
Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company
Нареш К. Будхаварам, доктор философии , Старший инженер-консультант, Eli Lilly and Company16:05 | Оценка воздействия на окружающую среду логистики глобальной цепочки поставок и выбор поставщиков устройств для инъекций
Аластер Уиллоуби, MEng, Руководитель отдела машиностроения, Team Consulting16:25 | Путь к дальнейшему повышению устойчивости автоинъекторов
16:45 | Вопросы и ответы
Бьярне Соренсен, Директор по передовым технологиям, Phillips-Medisize19:00 – 22:00 | Приемная
- 0
- СРЕДА, 19 ОКТЯБРЯ
07:15 – 08:15 | Параллельные сеансы завтрака
Завтрак 1: Растворы без силикона для предварительно наполненных шприцев
Модератор: Филипп Лауверс, Директор по развитию технологий, Terumo Pharmaceutical SolutionsС резким ростом популярности биотерапевтических препаратов возникает постоянная тенденция к созданию систем укупорки контейнеров, не содержащих силикона, для чувствительных биотехнологических препаратов.
 Первый докладчик представит экспериментальные результаты, полученные в результате сравнения как стеклянных, так и полимерных систем укупорки контейнеров, не содержащих силикон, с точки зрения функциональных характеристик и стабильности лекарств. В следующем докладе будут освещены конкретные проблемы, связанные с обработкой этих бессиликоновых каучуковых компонентов на стандартных линиях заполнения и отделки, а также будут разработаны решения.
Первый докладчик представит экспериментальные результаты, полученные в результате сравнения как стеклянных, так и полимерных систем укупорки контейнеров, не содержащих силикон, с точки зрения функциональных характеристик и стабильности лекарств. В следующем докладе будут освещены конкретные проблемы, связанные с обработкой этих бессиликоновых каучуковых компонентов на стандартных линиях заполнения и отделки, а также будут разработаны решения.07:15 | Практический пример: оценка шприцев, не содержащих силикона, подходящих для молекул, чувствительных к силиконовому маслу, и совместимых с существующими платформами медицинских устройств
Soeren Miethke, MSc, Senior Scientist PPMD, CSL Behring AG07:35 | Практический пример обработки предварительно заполненного компонента шприца, не содержащего силикона, для наполнения и отделки s
07:55 | Вопросы и ответы
Йорг Штумбаум, Руководитель проекта, PPS&P, Веттер
Чак В. Сейпел, Специалист по продукции, В.Л. Гор энд Ассошиэйтс
Сейпел, Специалист по продукции, В.Л. Гор энд Ассошиэйтс Завтрак 2: Платформы устройств
Модератор: Дебора Дюфресн, Руководитель отдела трубопроводов и комплексной проверки, PfizerНа этом занятии будут представлены идеи гибких решений для автоматизации, а также тематическое исследование аспектов устойчивости многоразового шприц-ручки на основе картриджа.
07:15 | Гибкие производственные платформы с интегрированными решениями автоматизации
Кристиан Коллекер, Директор по продажам асептических технологий, Харро Хёфлигер
Рудольф Михаэль Вайс, дипл.-инж., Global Head of Pharma+Medical, Stäubli07:35 | Реальный пример устойчивой доставки лекарств Разработка первого многоразового шприц-ручки для концентрированного инсулина
07:55 | Вопросы и ответы
Роб Визи, магистр наук, Старший менеджер сектора медицины и науки, DCA Design InternationalЗавтрак 3: Отслеживание PFS: тематические исследования решений на основе RFID для PFS
Эта сессия будет посвящена последним разработкам в области отслеживания PFS с использованием технологии RFID.
Модератор: Laurent Jeanmart, PhD, Руководитель отдела упаковки и медицинских устройств, GSK Спикеры расскажут о проблемах, а также о новых преимуществах и возможностях для пациентов и отрасли.
Спикеры расскажут о проблемах, а также о новых преимуществах и возможностях для пациентов и отрасли.07:15 | Улучшение прослеживаемости на уровне единиц PFS с помощью RFID
Франк Ван Рит, MS, Директор IHD-Ophtha Portfolio Mgmt Global Device & Packaging Development, Novartis International AG
Herve Soukiassian, Assoc. Директор по управлению программами, BD07:35 | Сделать PFS Smart: проблемы и возможности предварительно наполненных шприцев, оснащенных RFID
Арне Рем, Старший менеджер по продуктам RFID/NFC Solutions, Schreiner MediPharm
Том Ван Гиннекен, Руководитель отдела глобального управления продуктами SCHOTT TOPPAC®, SCHOTT 03 900 AG 07:55 | Вопросы и ответы08:30 – 10:00 | P3
Модератор: Джейкоб Ланге, доктор философии, Старший директор по системам доставки, Ипсомед АГ08:30 | Изменение к лучшему: использование дизайна, ориентированного на человека, для улучшения показателей здоровья
Маркус Вирцох, Старший директор по дизайну и человеческому фактору, Eli Lilly and Company09:00 | Внедрение нового продукта и опыт пациента: мысли за пределами BLA
09:30 | Вопросы и ответы
Шерри Бионди, доктор философии, Исполнительный директор, руководитель отдела разработки устройств, 9 лет0119 АстраЗенека10:00 – 10:45 | Перерыв, технические переговоры и стендовые доклады в выставочном зале
10:45 – 12:15 | Параллельные сеансы
A3: Преодоление разрыва: переход от стадии клинической разработки к поставке на коммерческий рынок
Переход изменений конструкции и процесса от разработки к поставке на коммерческий рынок может создать проблемы в стратегии разработки устройств.
Модератор: Кристиан Коллекер, Директор по продажам асептических технологий, Харро Хёфлигер На этом заседании будут представлены некоторые отраслевые примеры того, как преодолеть этот разрыв и решить все проблемы на пути от лаборатории к производству.
На этом заседании будут представлены некоторые отраслевые примеры того, как преодолеть этот разрыв и решить все проблемы на пути от лаборатории к производству.10:45 | Практический пример: как устранить различия между клиническим устройством, используемым в основных клинических исследованиях, и коммерческим устройством
Йик Кит (Грейс) Квок, MBA, Главный научный сотрудник, Merck & Co., Inc.11:05 | Оптимизация передачи проекта и масштабирование коммерческого использования: пример автоинжектора
Эми Хартл, доктор философии, Директор по развитию процессов, SHL Medical
Сынгил Юн, доктор философии, Вице-президент по разработке продуктов , Самсунг11:25 | Основные проблемы (и решения) при разработке и коммерциализации устройств для внутрикожной доставки лекарств
11:45 | Вопросы и ответы
Лиза Дик, доктор философии, Старший научный сотрудник, Kindeva Drug DeliveryB3: Человеческий фактор: путь к успешной сдаче
На этом занятии будут рассмотрены успешные стратегии, позволяющие гарантировать, что ваш комбинированный продукт и/или медицинское устройство получит одобрение регулирующих органов.
Модератор: Мэгги Рейфф, 9 лет0081 Вице-президент по развитию, ApiJect Corp Спикеры рассмотрят основные требования инженерии человеческого фактора, а также более сложные темы и стратегии для успешного представления человеческого фактора.
Спикеры рассмотрят основные требования инженерии человеческого фактора, а также более сложные темы и стратегии для успешного представления человеческого фактора.10:45 | Применение инженерии человеческого фактора для успешного представления FDA инъекционных устройств
Андреа Дуайер, MS, CHFP, Заместитель директора по исследованиям и проектированию человеческого фактора, Emergo by UL11:05 | Оптимизация стратегий оценки человеческого фактора для предварительно наполненных шприцев
Эстер Фу, доктор философии, Старший научный сотрудник, Merck & Co., Inc.11:25 | Человеческий фактор (HF) Горячая картошка: рассмотрение ключевых тем HF при проектировании, разработке и успешном утверждении на рынке комбинированных лекарственных препаратов и устройств
11:45 | Вопросы и ответы
Karl J. Saldanha, PhD, Regulatory Program Director, Genentech, Inc.
Saldanha, PhD, Regulatory Program Director, Genentech, Inc.
Michelle Hatch, MEng, Senior Human Factors Engineer, Genentech, Inc.C3: От IV до SC: Инновационные подходы к «системам доставки на тело»
Лечение доставки лекарств при болезненных состояниях, требующих более высоких доз, переходит от традиционного пути внутривенного введения к подкожной (п/к) инъекции. Многие преимущества новых систем «на теле» включают меньшую инвазивность и время подготовки, а также улучшенный уход и снижение затрат. Но они также приходят с проблемами. Посетите это занятие и узнайте об эволюции этих новых систем и о том, как они могут помочь в переносе доставки лекарств из больницы на дом и удовлетворении требований рынка.
Модератор: Бриджит Ройтер-Херле, Вице-президент по управлению продуктами и маркетингу, Веттер
10:45 | Последовательность первичных контейнеров для накладных инъекторов большого объема: от флакона до предварительно заполненного картриджа
11:05 | Как инновационные подходы к подкожной доставке лекарств могут сместить центр оказания медицинской помощи из больницы на дом: обоснование онкологии
Якоб Ланге, доктор философии, Старший директор по системам доставки, Ypsomed AG11:25 | Разработка системы доставки больших объемов с индивидуальным профилем инъекций (пример из практики)
11:45 | Вопросы и ответы
Пратик А. Мишра, MEng, Старший системный инженер, West Pharmaceutical Services, Inc.
Реут Атарот, Системная инженерия Менеджер, West Pharmaceutical Services, Inc.12:15 – 13:30 | Деловой обед и технические переговоры в выставочном зале
13:30 – 15:00 | Параллельные сеансы
A4: Сотрудничество с участием пациентов и новые технологии доставки
Прорывные разработки сосредоточены на комбинированных продуктах с конечной целью улучшения качества жизни пациентов и повышения приверженности терапии.
Модератор: Алессандро Морандотти, Руководитель отдела технического учета, Группа Стеванато Эта тенденция потребует адаптации существующих устройств и внедрения новых систем впрыска. На этом занятии мы представим обзор новых технологий и то, как основные соображения были учтены в процессе разработки, чтобы обеспечить функциональность устройства и ориентированность на пациента. Будут представлены ключевые факторы, такие как человеческий фактор, адаптация пациентов, сквозной производственный процесс.
Эта тенденция потребует адаптации существующих устройств и внедрения новых систем впрыска. На этом занятии мы представим обзор новых технологий и то, как основные соображения были учтены в процессе разработки, чтобы обеспечить функциональность устройства и ориентированность на пациента. Будут представлены ключевые факторы, такие как человеческий фактор, адаптация пациентов, сквозной производственный процесс.13:30 | Разработка нового многоразового автоинъектора для автоматического восстановления и введения лекарств из одноразового двухкамерного картриджа
Нильс Берг Мэдсен, доктор философии, Директор по разработке устройств, Ascendis Pharma
Пол Эрик Фабрициус, Директор, Front End Innovation , Phillips-Medisize13:50 | Интеграция новых рецептур лекарственных средств и технологий носимых помп для обеспечения неопиоидного обезболивания от умеренной до сильной вне клиники
Паоло Гольфетто, Директор по развитию бизнеса систем доставки лекарств, Stevanato Group
Шелдон Моберг, Массачусетс, Старший вице-президент по доставке лекарств, 09 Bexson1 Biomedical14:10 | Ориентированный на пациента подход к разработке новых решений для доставки лекарств на тело для инъекционных биологических препаратов: исследование с несколькими целевыми группами
14:30 | Вопросы и ответы
Реза Абедян, доктор философии, Старший менеджер по медицинским вопросам, GerresheimerB4: Обновление стандартов ISO и передовой практики регулирования
Модератор: Дебора ДюФресн, Руководитель отдела трубопроводов и должной осмотрительности, PfizerНа этой сессии будут обсуждаться последние разработки в области отраслевой стандартизации.
 Будут представлены обновленные сведения о стандартах ISO, а также обсуждены последствия и дальнейший путь.
Будут представлены обновленные сведения о стандартах ISO, а также обсуждены последствия и дальнейший путь.13:30 | Обзор международных стандартов, влияющих на устройства доставки, ISO TC84 и последние изменения в серии ISO 11608
13:50 | Все стандарты серии ISO 11608 являются новыми — что теперь?
Ли Лейхтер, RAC, MBA, 9 лет0081 Президент, P/L Biomedical14:10 | Статья 117 Регламента ЕС по медицинскому оборудованию: передовой опыт и возможности регулирования, связанные с мнением уполномоченного органа (NBOp)
14:30 | Вопросы и ответы
Стефани Г. Хорн, доктор философии, Менеджер по техническому регулированию, F. Hoffmann-La Roche Ltd.C4: Автоинъекторы: разработка для успеха
Модератор: Морис Вершурен, магистр наук, ведущий директор платформы устройств , AmgenНедавние разработки показали растущее предпочтение самостоятельного введения лекарств, при котором автоинъекторы стали одним из ключевых устройств доставки, поддерживающих подкожные инъекции.
 Эта сессия предоставит информацию о важнейших принципах проектирования во время разработки (большого объема) автоинъектора, включая оценки в реальном времени, чтобы поделиться важными знаниями от лидеров отрасли.
Эта сессия предоставит информацию о важнейших принципах проектирования во время разработки (большого объема) автоинъектора, включая оценки в реальном времени, чтобы поделиться важными знаниями от лидеров отрасли.13:30 | Усовершенствованная структура разработки продуктов для проектирования надежных автомобильных инжекторов
Дэвид Бут, PE, Старший консультант, LMI13:50 | Достаточно ли хороша конструкция платформы автоинъектора для нужд вашего проекта?
Хуан Ченг, доктор философии, Главный научный сотрудник, Мерк и Ко., Инк.14:10 | Внедрение вязкой доставки: влияние технологии игл на показатели производительности автоинжектора in vivo
Рон Петтис , Директор по трансляционным и клиническим наукам, BD
0 14:30 | Вопросы и ответы15:00 – 15:45 | Перерыв и постерные презентации в выставочном зале
15:45 – 17:30 | P4: Инвестиции в будущее
Модераторы: Джеффри Живанд, доктор философии, Исполнительный директор по разработке устройств и комбинированных продуктов, Merck & Co. , Inc. и Матиас Ромакер, Исполнительный советник, Kymanox
, Inc. и Матиас Ромакер, Исполнительный советник, Kymanox На этом заключительном заседании, которое нельзя пропустить, Дон Джонс и Джим Коллинз расскажут о том, как развивается рынок доставки лекарств, устройств и подключенного ухода, а также о том, как ключевые тенденции могут быть оценены для инвестиций компаниями, производящими устройства для доставки и биофармацевтическими компаниями. . Сессия будет включать в себя обсуждение ключевых возможностей и предстоящих задач, а также того, как представители биофармацевтики должны оценивать варианты инвестиций на этом будущем меняющемся рынке.
15:45 | Дональд Джонс, JD, MBA, Председатель, Cardiff Ocean Group
16:05 | Джеймс Дж. Коллинз-младший, MBA , президент, Pharmaceutical Delivery Systems LLC
16:25 | Чат у камина и вопросы и ответы
17:15 | Заключительное слово сопредседателей конференции Следующие плакаты будут представлены во время каждого перерыва в выставочном зале
Новое устройство для восстановления и введения Activase® 100 мг
Патрик Грандт , инженер по медицинскому оборудованию, Genentech, Inc.
Платформа для упаковки предварительно наполненных шприцев и самоинъекционных устройств; Как соблюдение требований на уровне отделения может улучшить результаты лечения
Питер Гомппер, MSc, MBA , соучредитель, RubitelИтеративный процесс, использующий сбор реальных данных для улучшения поддержки пациентов с диабетом
Chelsea Williams, MPH , Менеджер по цифровому здравоохранению, SHL MedicalПоведение шприцев при -80°C с использованием анализа методом конечных элементов и компьютерной томографии
Md Abu Hasan, Главный инженер отдела исследований и разработок, West Pharmaceutical Services, Inc.Характеристики движения стопора плунжера
Гуанли Ху, доктор философии , главный научный сотрудник, Merck & Co. , Inc.
, Inc. Характеристика выщелачивания силиконового масла и его влияние на биологический лекарственный продукт в предварительно наполненных шприцах
Си Чжао, Старший научный сотрудник, Merck & Co., Inc.Рассмотрение глубины введения иглы при подкожной доставке лекарств
Иэн Симпсон, Коммерческий директор, Phillips-MedisizeПередовые технологии асептического переноса в отношении ATMP и ADC (мАт)
Юрген Мецгер , специалист по продуктам, Sartorius North America Inc.Разработка и адаптация смазочных материалов и сопутствующих материалов для удовлетворения разнообразных потребностей индустрии парентеральной доставки лекарств
Кристофер Андреола, доктор философии , старший менеджер по продуктам и инновациям — МЕДИЦИНА, Nye Lubricants, Inc. (FUCHS Group)
(FUCHS Group) Разработка устройства для подслизистой инъекции для пероральной биотерапевтической системы доставки
Шерил Сторк, Ученый II, доклинический перевод, Biora TherapeuticsЦифровые решения для здравоохранения: путь от разработки к применению
Рохит Вора, Стратегический маркетинг, комбинированные продукты, West Pharmaceutical Services, Inc.Разработка и планирование жизненного цикла комбинированных лекарственных препаратов (DDCP)
Диего Зурбригген, Старший менеджер по стратегическим исследованиям и анализу жизненного цикла, West Pharmaceutical Services, Inc.Попадание красителя для проверки герметичности укупорки контейнера (CCIT) предварительно заполненных шприцев — оптимизация или вывод из эксплуатации?
Элизабет Морони, Главный научный сотрудник, Bristol Myers SquibbВлияние даты изготовления на частицы силиконового масла в предварительно наполненных шприцах
Гуанли Ху, Главный научный сотрудник, Merck & Co. , Inc.
, Inc. Эластомерные плунжеры с фторполимерными барьерными пленками – применение для новых лекарственных препаратов
Пейдж МакЭндрю, доктор философии , директор отдела научных коммуникаций, West Pharmaceutical Services, Inc.Безыгольные инъекции с электронным управлением: понимание переменных, влияющих на эффективность инъекции
Арджун Манодж, инженер-биомедик, Portal InstrumentsОбеспечение ориентации на пациентов при переводе лечения из стационара на домашний
Марк Тункель, 9 лет0081 Глобальный директор категории — Услуги, NemeraОценка функциональных характеристик поршня шприца для обеспечения интеграции PFS и автоматического инъектора и обрабатываемости на линиях розлива: пример использования поршня шприца PremiumCoat® 1-3 мл
Себастьен Кордье, Технический менеджер по продукции, Aptar PharmaС точки зрения пользователя: использование технологии отслеживания взгляда в исследованиях человеческого фактора для оценки и улучшения удобства использования инъекционных устройств
Дэнни Миранда, доктор философии , заместитель директора отдела инженерии человеческого фактора, Bristol Myers SquibbПолучение максимальной отдачи от оценки жизненного цикла при разработке продукта
Изобель Филипова, Инженер-конструктор, Оуэн МамфордКак обеспечить совместимость шприц-автоинжектор? Информация от PFS Manufacturing для AI
Стефано Пилати, Координатор по технической оценке и разработке продукции, Stevanato GroupКак эффективно использовать цепочку поставок вашего устройства и быстрее вывести на рынок уникальные комбинированные продукты и медицинские устройства
Марк Циммерман, Business Development, Kimball ElectronicsКак стать партнером для побед
Марк Циммерман, MBA , развитие бизнеса, Kimball ElectronicsКак изучить и поддерживать целостность крышки контейнера предварительно наполненных стеклянных шприцев во время циклов глубокого холодного хранения
Людовик Гил, Инженер-исследователь, BDПодход, основанный на человеческом факторе, для включения возможностей подключения в возможности подключения медицинских устройств
Финола Остин, MScErg , инженер по человеческому фактору, Оуэн МамфордВажность стержня автоинъектора объемом 2,25 мл для пространства конструкции плунжера – упускаемый из виду критический вклад в точность дозы и устранение утечки
Тибор Хлобик, Старший директор службы технологии продуктов, West Pharmaceutical Services, Inc.
Учет соображений устойчивого развития в процессе выбора устройства
Сэмюэл Дофине, MBA , менеджер по исследованиям и разработкам, разработка продукции, West Pharmaceutical Services, Inc. Вест Фармасьютикал Сервисез, Инк.Инновационные методологии для ускорения разработки комбинированных продуктов для новых лекарственных препаратов, включающих доставку высоких доз высоковязких составов
Асмита Ханолкар, MS , старший директор, Cambridge Pharma, Oval, SMCИнтеграция новых технологий с существующими системами – проблемы и возможности
Свагат Сангамнеркар, Директор, MS&T, Renaissance Lakewood LLCОсновные аспекты проектирования системы впрыска для аварийного использования
Джон Берк, Старший консультант, Team ConsultingПодкожная инъекция больших объемов: модели осуществимости и приемлемости в серии трансляционных исследований
Венди Вудли, Штатный научный сотрудник II, BDУправление разработкой программного обеспечения для системы доставки на тело с использованием рекомендаций FDA и стандартов ISO/IEC
Кэтрин Хаффер, Менеджер отдела исследований и разработок, проверка, West Pharmaceutical Services, Inc. наполненные шприцы
наполненные шприцы
Лейлей Чжан, Заместитель главного научного сотрудника, Merck & Co., Inc .Механическая заливка и контроль доставки лекарственного средства в многоразовом автоинжекторе
Роб Холл, Менеджер группы дизайнеров — Дизайн продукта, Оуэн МамфордВалидация метода испытаний медицинских устройств: практические стратегии преодоления распространенных проблем с разрушающими приборами R&R
Джо Дель Росси, MS , директор R&D Labs, West Pharmaceutical Services, Inc. Лаборатория, West Pharmaceutical Services, Inc.Взаимодействие иглы и ткани в связи с конструкцией автоинъекторов
Энн-Софи Стейплз, магистр наук , аспирант, Университет Копенгагена/Ново Нордиск A/SПроизводство новых материалов и передовых технологий производства пленок Обработка стерильных инъекционных препаратов и готовая лекарственная форма посредством реконструированной цепочки поставок
Амир Геносар, Генеральный директор, Aktiv Pharma GroupПрактические реализации процесса проектирования и управления критическими параметрами (CPDM) в программах аварийного использования инжекторов
Томас Джеймс, Инженер-механик, Key Tech
Доклиническая оценка давления подкожной инъекции для исследовательского накладного инъектора
Венди Вудли, Штатный научный сотрудник II, BDАвтоматический инжектор с демпфированием сдвига – новый подход к снижению рисков и трудностей, связанных с инъекцией высоковязких и неотложных фармацевтических препаратов
Питер Холст, Соучредитель и генеральный директор, 9 лет0119 Ф. Прин, ООО
Прин, ООО Технические и нормативные аспекты внедрения платформы устройств PFS и ИИ
Хуан Ченг, Главный научный сотрудник, Merck & Co., Inc.Искусство наполнения и обработки предварительно наполненного шприца
Клаус Ульхерр, Старший менеджер по продукции, Syntegon Technology GmbHЦикл полезной обратной связи «цифрового близнеца»
Брэд Уомбл, Управляющий директор, Healthcare Strategy, Jabil, Inc.Использование CM&S нормативного уровня систем доставки лекарств для ускорения разработки устройств
Мэгги Рейфф, Вице-президент по развитию, ApiJect CorpРазмещение
Конференция PDA Universe по предварительно заполненным шприцам и инъекционным устройствам 2022 года проводится в конференц-центре Палм-Спрингс в Палм-Спрингс, Калифорния.

В отеле Courtyard Palm Springs для участников встречи зарезервирован блок номеров. Групповой тариф во всех отелях составляет 199 долларов США при одноместном или двухместном размещении. Стоимость номера указана с учетом государственных и местных налогов. Бронирование должно быть обеспечено Пятница, 30 сентября 2022 года . После этой даты бронировать места можно только в зависимости от наличия свободных мест и тарифов. Чтобы сделать бронирование, физические лица должны нажать на ссылку бронирования выше.
Гостиницы «Ренессанс Палм-Спрингс» и «Хилтон Палм-Спрингс» распроданы.
Имейте в виду, что получение и отмена брони в гостинице является обязанностью участника, зарегистрировавшегося на встречу. Физические лица будут нести ответственность за оплату своих собственных сборов за отмену бронирования. Отмена бронирования производится за 3 дня до прибытия, если иное не указано в информации о бронировании.
Удобства
6
Использование европейской SIM-карты Рик Стивс
Рик Стивс
Пользоваться американским телефоном в Европе легко, но это может быть дорого. А ненадежный Wi-Fi может сделать общение через такие службы, как Skype, более неприятным, чем должно быть.
Если вы предполагаете интенсивное использование телефона или данных, рассмотрите возможность путешествия с мобильным телефоном с европейской SIM-картой. Это дает вам европейский номер мобильного телефона и доступ к более низким тарифам, чем у вашего американского оператора, даже с международным планом. Как правило, с европейской SIM-картой можно бесплатно получать внутренние текстовые сообщения и звонки, около 2–20 центов в минуту за внутренние звонки и звонки в пределах ЕС и 5–15 центов за отправку текстовых сообщений в пределах ЕС. Чтобы получить лучшие тарифы, покупайте новую SIM-карту каждый раз, когда приезжаете в новую страну.
Это дает вам европейский номер мобильного телефона и доступ к более низким тарифам, чем у вашего американского оператора, даже с международным планом. Как правило, с европейской SIM-картой можно бесплатно получать внутренние текстовые сообщения и звонки, около 2–20 центов в минуту за внутренние звонки и звонки в пределах ЕС и 5–15 центов за отправку текстовых сообщений в пределах ЕС. Чтобы получить лучшие тарифы, покупайте новую SIM-карту каждый раз, когда приезжаете в новую страну.
Чтобы получить европейскую SIM-карту, вам необходимо сделать следующее:
1. Убедитесь, что у вас есть подходящий телефон. Вам понадобится либо европейский телефон, либо разблокированный телефон, чтобы европейская SIM-карта работала (некоторые телефоны электронно «заблокированы», поэтому вы не можете переключать SIM-карты). Уточните у своего оператора — возможно, ваш телефон уже разблокирован, так как эта функция становится все более распространенной в новых моделях. В противном случае вы можете попробовать спросить своего провайдера, разблокируют ли они его для вас. Помните, что пока в вашем телефоне установлена европейская SIM-карта, вы не сможете дозвониться по обычному номеру в США.
Помните, что пока в вашем телефоне установлена европейская SIM-карта, вы не сможете дозвониться по обычному номеру в США.
Если разблокировать телефон невозможно, вы можете купить разблокированный телефон перед поездкой или в пункте назначения (около 40 долларов США за обычный разблокированный телефон). Также в Европе можно купить недорогой мобильный телефон с SIM-картой. Хотя эти телефоны, как правило, заблокированы для работы только с одним провайдером (это означает, что вы не можете переключиться на другую европейскую SIM-карту, если путешествуете в другие страны), они могут быть даже дешевле (20 долларов или меньше, и часто с достаточным количеством предоплаченного кредита для звонков, чтобы сделать сам телефон практически бесплатный). Если вы покупаете телефон в Европе, используйте европейский термин «мобильный» (произносится как британцы — рифмуется со словом «улыбка») или «удобный» (распространенный в немецкоязычных регионах).
Наконец, возможно, у вас где-то в ящике уже лежит старый неиспользуемый мобильный телефон. Возможно, он заблокирован, но ваш провайдер может отправить вам код для его разблокировки.
Возможно, он заблокирован, но ваш провайдер может отправить вам код для его разблокировки.
2. Присмотритесь к SIM-карте. SIM-карты продаются в Европе в магазинах мобильных телефонов, прилавках универмагов электроники, в некоторых газетных киосках и даже в торговых автоматах. Стоя около 5–10 долларов, они обычно включают примерно такой же предоплаченный кредит на звонки без контракта и без каких-либо обязательств. Некоторые бренды, в том числе Lebara, надежны и обеспечивают дешевые международные звонки, в том числе в США.
Если у вас есть смартфон, найдите SIM-карту, на которой также есть данные. Будьте готовы заплатить около 15-30 долларов за SIM-карту, которая включает один месяц данных в стране, в которой вы ее купили. Имейте в виду, что многие смартфоны (особенно iPhone) используют карты micro-SIM или nano-SIM меньшего размера. Убедитесь, что вы приобрели карту памяти подходящего размера для своего телефона.
Перед покупкой SIM-карты узнайте у продавца тарифы на звонки внутри страны; в и из других стран, которые вы будете посещать; и, если вы планируете звонить домой, в США и Канаду. Также проверьте тарифы на использование данных и на отправку/получение текстовых сообщений (называемых «SMS» в Европе). Убедитесь, что вы получаете тарифы на передачу данных и текстовые сообщения как в стране проживания карты, так и за ее пределами. Цены могут сильно различаться от бренда к бренду и от магазина к магазину.
Также проверьте тарифы на использование данных и на отправку/получение текстовых сообщений (называемых «SMS» в Европе). Убедитесь, что вы получаете тарифы на передачу данных и текстовые сообщения как в стране проживания карты, так и за ее пределами. Цены могут сильно различаться от бренда к бренду и от магазина к магазину.
3. Настройте SIM-карту. После покупки SIM-карты попросите продавца вставить ее, настроить и сделать тестовый звонок, чтобы убедиться, что она работает правильно. При включении телефона вам будет предложено ввести PIN-код SIM-карты, который может потребоваться вводить при каждом включении телефона. Если текстовые или голосовые подсказки на другом языке, спросите у служащего, можно ли их переключить на английский язык. Также узнайте, как проверить свой кредитный баланс (обычно вы вводите несколько цифр и нажимаете «Отправить»). Не забудьте записать свой новый номер телефона, чтобы вы могли передать его друзьям и семье.
Обратите внимание, что во многих странах требуется зарегистрировать SIM-карту вместе с паспортом в качестве антитеррористической меры. В этом случае может пройти час или два после отправки информации, прежде чем вы сможете пользоваться телефоном.
В этом случае может пройти час или два после отправки информации, прежде чем вы сможете пользоваться телефоном.
4. Пополните SIM-карту. Когда у вас закончился кредит, вы можете пополнить его в газетных киосках, табачных магазинах, магазинах мобильных телефонов или во многих других местах (ищите логотип SIM-карты в окне). Скажите клерку, сколько кредита вы хотите. Вы либо получите ваучер с инструкциями (в большинстве случаев, чтобы пополнить кредит, вы набираете длинную строку цифр на своем телефоне), либо клерк отправит кредит прямо на ваш телефон. Некоторые провайдеры позволяют пополнять счет онлайн.
Советы: Имейте в виду, что срок действия большинства европейских SIM-карт истекает после определенного периода бездействия (обычно 3–12 месяцев), поэтому используйте кредит или передайте его другому путешественнику. Также обязательно сохраняйте номера телефонов контактов в самом телефоне, а не на SIM-карте; в противном случае вы потеряете к ним доступ при смене SIM-карты. При сохранении телефонных номеров включите знак плюс (+) и код страны, чтобы гарантировать, что ваши звонки будут проходить, независимо от того, откуда вы звоните.
При сохранении телефонных номеров включите знак плюс (+) и код страны, чтобы гарантировать, что ваши звонки будут проходить, независимо от того, откуда вы звоните.
2022 Конференция PDA Universe of Pre-filled шприцев и инъекционных устройств
18 октября — 19 октября 2022 г.
Палм-Спрингс, Калифорния
Новый стандарт доставки инъекционных препаратов
Зарегистрируйтесь сейчас
осталось зарегистрироваться
Основные моменты программы
Повестка дня доступна! Вы не можете пропустить заключительную сессию «Инвестиции в будущее» с участием Дональда Джонса, доктора юридических наук, MBA, председателя, 9 лет. 0119 Cardiff Ocean Group и Джеймс Дж. Коллинз-младший, магистр делового администрирования, президент Pharmaceutical Delivery Systems LLC.
0119 Cardiff Ocean Group и Джеймс Дж. Коллинз-младший, магистр делового администрирования, президент Pharmaceutical Delivery Systems LLC.
Обзор
Конференция «Вселенная предварительно заполненных шприцев и инъекционных устройств PDA 2022» будет продолжать укреплять репутацию прошлых мероприятий, освещая последние достижения в этой области. На этой конференции будет рассмотрено будущее фармацевтических устройств, например, быстрый технологический прогресс, который будет способствовать развитию отрасли, а также соберутся отраслевые эксперты, чтобы поделиться своим опытом, новыми разработками, нормативными соображениями, проблемами и отраслевыми тенденциями в этой захватывающей области.
Непрерывное совершенствование материалов для изготовления, производственных процессов, процессов инъекций и защитных устройств, а также другие технологические усовершенствования создают динамичную среду в области устройств для доставки лекарств. Нормативные требования, отраслевой опыт и развивающиеся рыночные тенденции являются критически важными факторами для обеспечения полного понимания применения предварительно заполненных шприцев или других предварительно заполненных контейнеров и инъекционных устройств для доставки лекарств. Проблемы внедрения новых продуктов и поддержки существующих продуктов требуют, чтобы компании были в курсе новых разработок.
Проблемы внедрения новых продуктов и поддержки существующих продуктов требуют, чтобы компании были в курсе новых разработок.
Повестка дня
Выделенные динамики
Sherri Biondi
AstraZeneca
Amy Hartl
SHL Medical
Reto Jost
Ypsomed AG
Akshay R.
 Kamdar
KamdarEli Lilly and Company
Lee Leichter
P/L Biomedical
John Ludwig
Pfizer, Inc.
Gregg Peterson
Bexson Biomedical
Mathias Romacker
Kymanox
Дополнительная информация
Есть вопрос? У нас есть ответы
Свяжитесь с намиПутешествия
ПОЖАЛУЙСТА, ПРОЧИТАЙТЕ PDA не является аффилированным лицом и не имеет контрактов с какой-либо сторонней подрядной компанией, работающей в отеле. Если кто-либо, кроме PDA или отеля, выбранного PDA, свяжется с вами и предложит представить какое-либо мероприятие PDA, он этого не сделает. PDA рекомендует бронировать отель напрямую через официальный выбранный PDA отель, указанный на нашем веб-сайте.
Как добраться
Самолетом
Международный аэропорт Палм-Спрингс (PSP) расположен всего в нескольких минутах от центра города Палм-Спрингс и конференц-центра.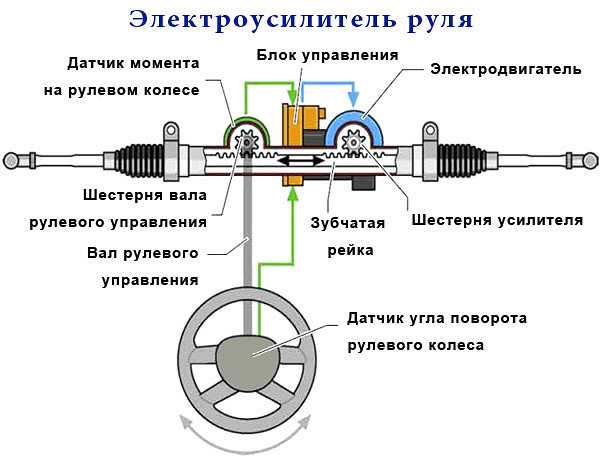 Этот аэропорт обслуживается многочисленными перевозчиками.
Стоимость проезда на такси от PSP составляет примерно 10 долларов США в одну сторону, не считая чаевых, и поездка займет около 7 минут.
Этот аэропорт обслуживается многочисленными перевозчиками.
Стоимость проезда на такси от PSP составляет примерно 10 долларов США в одну сторону, не считая чаевых, и поездка займет около 7 минут.
На машине
Конференц-центр Палм-Спрингс расположен по адресу: 277 N Avenida Caballeros, Палм-Спрингс, Калифорния
. Парковка расположена к востоку от объекта (Кабальерос Лот) и юго-западу от объекта (Андреас Лот). Стоимость парковки в конференц-центре составляет 10 долларов США в день.
Другие опции
Международный аэропорт Онтарио (ONT) находится в 70 милях от конференц-центра. Международный аэропорт Лос-Анджелеса (LAX) находится в 124 милях от конференц-центра.
Направления
Регистрационные сборы
Обычная цена
| Тип регистрации | | После 21 августа |
|---|---|---|
| Член (М) | | 2495 долларов |
| Не член (Нью-Мексико) |  США США | 2795 долларов |
| Правительство/Управление здравоохранения/Академический (M/NM) | | 700 долларов |
| Студент (M/NM) | | $350 |
| Специалист по раннему развитию (только для участников) | | 1245 долларов |
Избранные экспоненты
Мошенничество со списками участников по электронной почте
К сожалению, циркулируют электронные письма с предложениями продать списки участников многих конференций и мероприятий PDA. Эти письма рассылают мошенники.
Примечание : PDA не продает свои списки экспонентов или посетителей, и ни одна третья сторона не уполномочена распространять или продавать какие-либо списки, связанные с нашими мероприятиями.


 Возможно, его нужно просто зарядить;
Возможно, его нужно просто зарядить; Для этого с помощью молотка и зубила наносят косые удары по головке каждого болта против часовой стрелки, как бы пытаясь их открутить. Может даже не получиться, поэтому часто приходится пользоваться дрелью, чтобы их высверлить. Вообще, болты эти повторно не используются, и щадить их не нужно, т.к. при каждой установке замка применяют новые болты;
Для этого с помощью молотка и зубила наносят косые удары по головке каждого болта против часовой стрелки, как бы пытаясь их открутить. Может даже не получиться, поэтому часто приходится пользоваться дрелью, чтобы их высверлить. Вообще, болты эти повторно не используются, и щадить их не нужно, т.к. при каждой установке замка применяют новые болты; С помощью цветного маркера или другого обозначения, отмечаем положение рулевого колеса на валу, которое соответствует его прямой ориентации;
С помощью цветного маркера или другого обозначения, отмечаем положение рулевого колеса на валу, которое соответствует его прямой ориентации; Выкручиваем болт головкой на 13;
Выкручиваем болт головкой на 13;
 Либо отнести на сервис, и попытаться отремонтировать там. Если пропала связь с ЭБУ ЭУР «Приоры», то это, скорее всего, второй разъём, со шлейфом проводов, то же и в случае неполучения сигнала для блока, от внешних датчиков — коленчатого вала и распредвала. Да, да они также важны для работы устройства. В этих случаях можно снять и отремонтировать, или заменить недорогой пучок проводов.
Либо отнести на сервис, и попытаться отремонтировать там. Если пропала связь с ЭБУ ЭУР «Приоры», то это, скорее всего, второй разъём, со шлейфом проводов, то же и в случае неполучения сигнала для блока, от внешних датчиков — коленчатого вала и распредвала. Да, да они также важны для работы устройства. В этих случаях можно снять и отремонтировать, или заменить недорогой пучок проводов.


 Затем демонтируйте руль, заранее сняв пластиковую накладку под ним и на контрольном щитке. Демонтаж руля проводится в соответствии с сервисной книжкой к автомобилю.
Затем демонтируйте руль, заранее сняв пластиковую накладку под ним и на контрольном щитке. Демонтаж руля проводится в соответствии с сервисной книжкой к автомобилю.















 Внесен в реестр экспертных групп Комиссии под номером X03565. Его миссия включает «обеспечение согласованного выполнения» новых Правил. >>> нажмите здесь <<<
Внесен в реестр экспертных групп Комиссии под номером X03565. Его миссия включает «обеспечение согласованного выполнения» новых Правил. >>> нажмите здесь <<< МЛУ и EU IVDR. Хотя эта дорожная карта первой версии не содержит временных рамок, в ней указывается приоритет, отдаваемый соответствующим документам. >>> нажмите здесь <<<
МЛУ и EU IVDR. Хотя эта дорожная карта первой версии не содержит временных рамок, в ней указывается приоритет, отдаваемый соответствующим документам. >>> нажмите здесь <<< В октябре 2017 года швейцарский парламент принял временный закон (Medizinprodukteverordnung (MepV)), который позволяет нотифицированным органам-кандидатам, базирующимся в Швейцарии, подавать в Swissmedic заявки на назначение в соответствии с новыми правилами ЕС. Это также позволяет Swissmedic назначать экспертов в новую Координационную группу по медицинскому оборудованию ЕС (MDGC). Однако швейцарские версии новых правил ЕС по MDR и IVDR все еще находятся в стадии разработки. >>> нажмите здесь <<<
В октябре 2017 года швейцарский парламент принял временный закон (Medizinprodukteverordnung (MepV)), который позволяет нотифицированным органам-кандидатам, базирующимся в Швейцарии, подавать в Swissmedic заявки на назначение в соответствии с новыми правилами ЕС. Это также позволяет Swissmedic назначать экспертов в новую Координационную группу по медицинскому оборудованию ЕС (MDGC). Однако швейцарские версии новых правил ЕС по MDR и IVDR все еще находятся в стадии разработки. >>> нажмите здесь <<< 





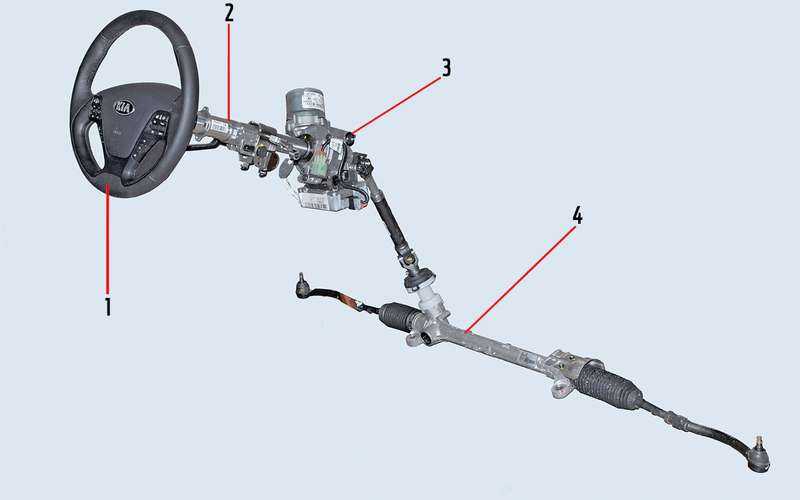
 В первой презентации д-р Джон Людвиг расскажет аудитории об удивительном путешествии Pfizer по разработке вакцины против COVID-19. Как это было сделано, каковы были препятствия, уроки и как это можно было сделать так быстро? Спикер завершит дискуссию о том, как применять парадигмы скорости света для будущих успехов. После этого д-р Рональд Форстер из Amgen расскажет о преимуществах разработки платформенных технологий и о том, как они обеспечивают постоянное улучшение пути пациента за счет качества продукции, инноваций и эффективности производства. Доктор Форстер также подробно расскажет о том, как использовать идеи, полученные из других отраслей.
В первой презентации д-р Джон Людвиг расскажет аудитории об удивительном путешествии Pfizer по разработке вакцины против COVID-19. Как это было сделано, каковы были препятствия, уроки и как это можно было сделать так быстро? Спикер завершит дискуссию о том, как применять парадигмы скорости света для будущих успехов. После этого д-р Рональд Форстер из Amgen расскажет о преимуществах разработки платформенных технологий и о том, как они обеспечивают постоянное улучшение пути пациента за счет качества продукции, инноваций и эффективности производства. Доктор Форстер также подробно расскажет о том, как использовать идеи, полученные из других отраслей. , Inc.
, Inc.  , Inc.
, Inc. 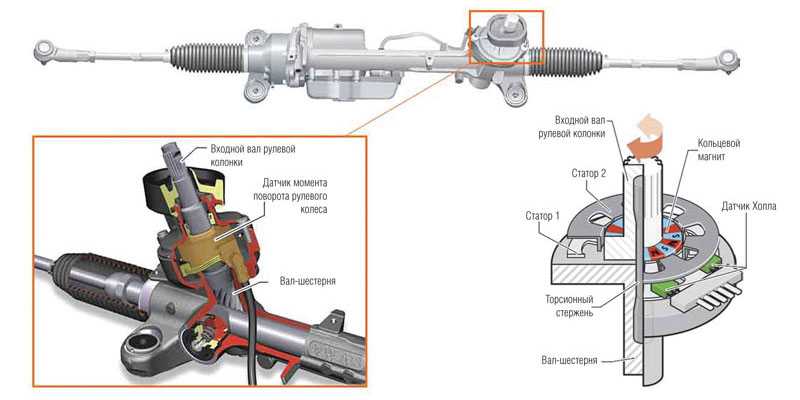 Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company
Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company  Джонс, PhD, DSc, Руководитель отдела исследований и инноваций, Novartis International AG
Джонс, PhD, DSc, Руководитель отдела исследований и инноваций, Novartis International AG  Тенденция к перемещению терапии в домашних условиях была известна в течение некоторого времени, но пандемия ускорила и изменила стратегии разработки лекарств. На этом занятии будут рассмотрены различные возможности для того, чтобы сделать доставку лекарств на дому реальностью — от интеллектуальных устройств доставки для домашних условий, позволяющих использовать первичные контейнеры для одноразового использования, до обучения пациентов и бортовых решений, специально разработанных для домашнего использования.
Тенденция к перемещению терапии в домашних условиях была известна в течение некоторого времени, но пандемия ускорила и изменила стратегии разработки лекарств. На этом занятии будут рассмотрены различные возможности для того, чтобы сделать доставку лекарств на дому реальностью — от интеллектуальных устройств доставки для домашних условий, позволяющих использовать первичные контейнеры для одноразового использования, до обучения пациентов и бортовых решений, специально разработанных для домашнего использования. и коммерциализация, разработка/коммерциализация устройств, Novartis International AG
и коммерциализация, разработка/коммерциализация устройств, Novartis International AG  Бэнкстон, доктор философии, вице-президент по работе с клиентами, BD
Бэнкстон, доктор философии, вице-президент по работе с клиентами, BD  Пиза, MSc, MA, Руководитель отдела человеческого фактора, Crux Product Design Ltd
Пиза, MSc, MA, Руководитель отдела человеческого фактора, Crux Product Design Ltd  На этом занятии докладчики опишут различные подходы к улучшению и контролю взаимодействия CCI и контейнеров с лекарствами в течение срока годности при низких температурах.
На этом занятии докладчики опишут различные подходы к улучшению и контролю взаимодействия CCI и контейнеров с лекарствами в течение срока годности при низких температурах.
 Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company
Камдар, доктор философии, Старший директор по закрытию контейнеров, разработке материалов и инновациям процессов, Eli Lilly and Company  Первый докладчик представит экспериментальные результаты, полученные в результате сравнения как стеклянных, так и полимерных систем укупорки контейнеров, не содержащих силикон, с точки зрения функциональных характеристик и стабильности лекарств. В следующем докладе будут освещены конкретные проблемы, связанные с обработкой этих бессиликоновых каучуковых компонентов на стандартных линиях заполнения и отделки, а также будут разработаны решения.
Первый докладчик представит экспериментальные результаты, полученные в результате сравнения как стеклянных, так и полимерных систем укупорки контейнеров, не содержащих силикон, с точки зрения функциональных характеристик и стабильности лекарств. В следующем докладе будут освещены конкретные проблемы, связанные с обработкой этих бессиликоновых каучуковых компонентов на стандартных линиях заполнения и отделки, а также будут разработаны решения. Сейпел, Специалист по продукции, В.Л. Гор энд Ассошиэйтс
Сейпел, Специалист по продукции, В.Л. Гор энд Ассошиэйтс  Спикеры расскажут о проблемах, а также о новых преимуществах и возможностях для пациентов и отрасли.
Спикеры расскажут о проблемах, а также о новых преимуществах и возможностях для пациентов и отрасли. На этом заседании будут представлены некоторые отраслевые примеры того, как преодолеть этот разрыв и решить все проблемы на пути от лаборатории к производству.
На этом заседании будут представлены некоторые отраслевые примеры того, как преодолеть этот разрыв и решить все проблемы на пути от лаборатории к производству. Спикеры рассмотрят основные требования инженерии человеческого фактора, а также более сложные темы и стратегии для успешного представления человеческого фактора.
Спикеры рассмотрят основные требования инженерии человеческого фактора, а также более сложные темы и стратегии для успешного представления человеческого фактора. Saldanha, PhD, Regulatory Program Director, Genentech, Inc.
Saldanha, PhD, Regulatory Program Director, Genentech, Inc. 
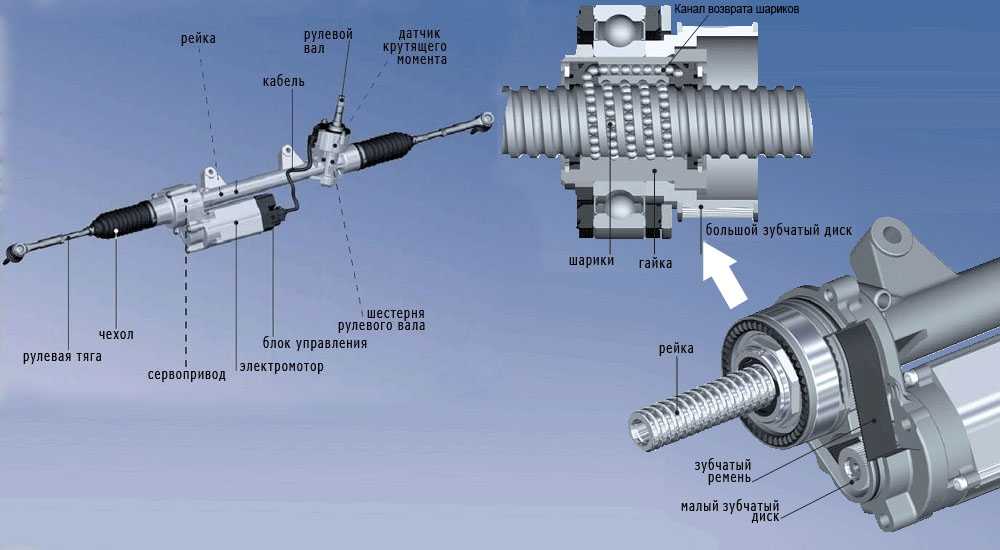 Эта тенденция потребует адаптации существующих устройств и внедрения новых систем впрыска. На этом занятии мы представим обзор новых технологий и то, как основные соображения были учтены в процессе разработки, чтобы обеспечить функциональность устройства и ориентированность на пациента. Будут представлены ключевые факторы, такие как человеческий фактор, адаптация пациентов, сквозной производственный процесс.
Эта тенденция потребует адаптации существующих устройств и внедрения новых систем впрыска. На этом занятии мы представим обзор новых технологий и то, как основные соображения были учтены в процессе разработки, чтобы обеспечить функциональность устройства и ориентированность на пациента. Будут представлены ключевые факторы, такие как человеческий фактор, адаптация пациентов, сквозной производственный процесс. Будут представлены обновленные сведения о стандартах ISO, а также обсуждены последствия и дальнейший путь.
Будут представлены обновленные сведения о стандартах ISO, а также обсуждены последствия и дальнейший путь.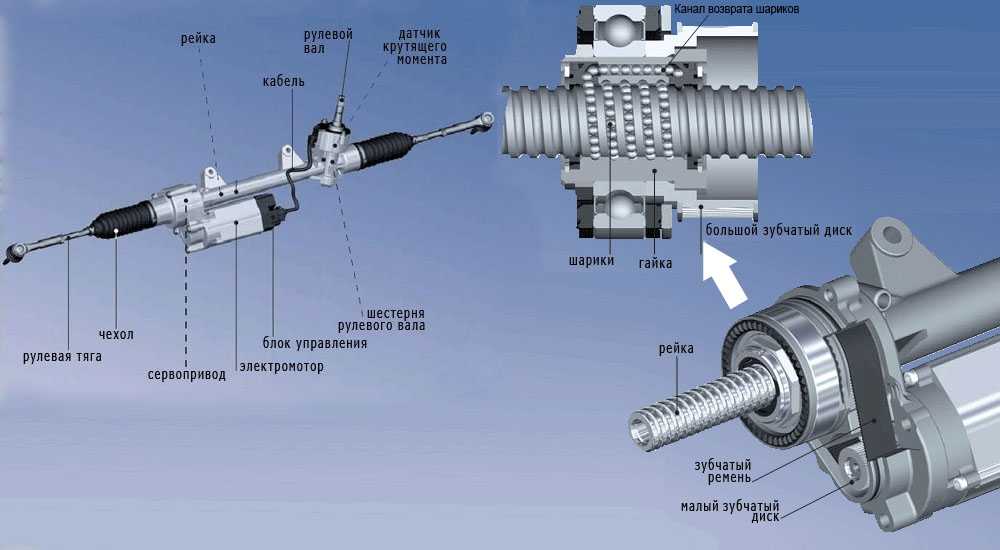 Эта сессия предоставит информацию о важнейших принципах проектирования во время разработки (большого объема) автоинъектора, включая оценки в реальном времени, чтобы поделиться важными знаниями от лидеров отрасли.
Эта сессия предоставит информацию о важнейших принципах проектирования во время разработки (большого объема) автоинъектора, включая оценки в реальном времени, чтобы поделиться важными знаниями от лидеров отрасли. , Inc. и Матиас Ромакер, Исполнительный советник, Kymanox
, Inc. и Матиас Ромакер, Исполнительный советник, Kymanox 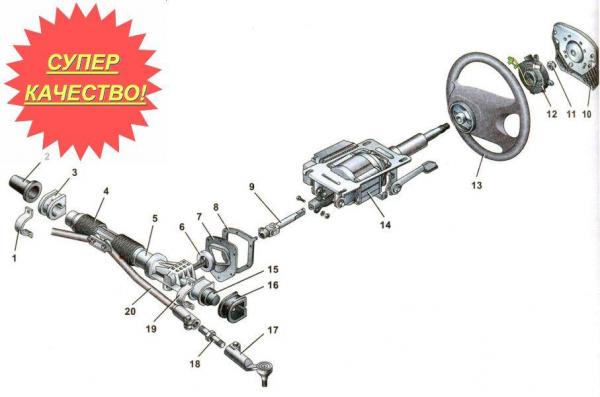
 , Inc.
, Inc.  (FUCHS Group)
(FUCHS Group) 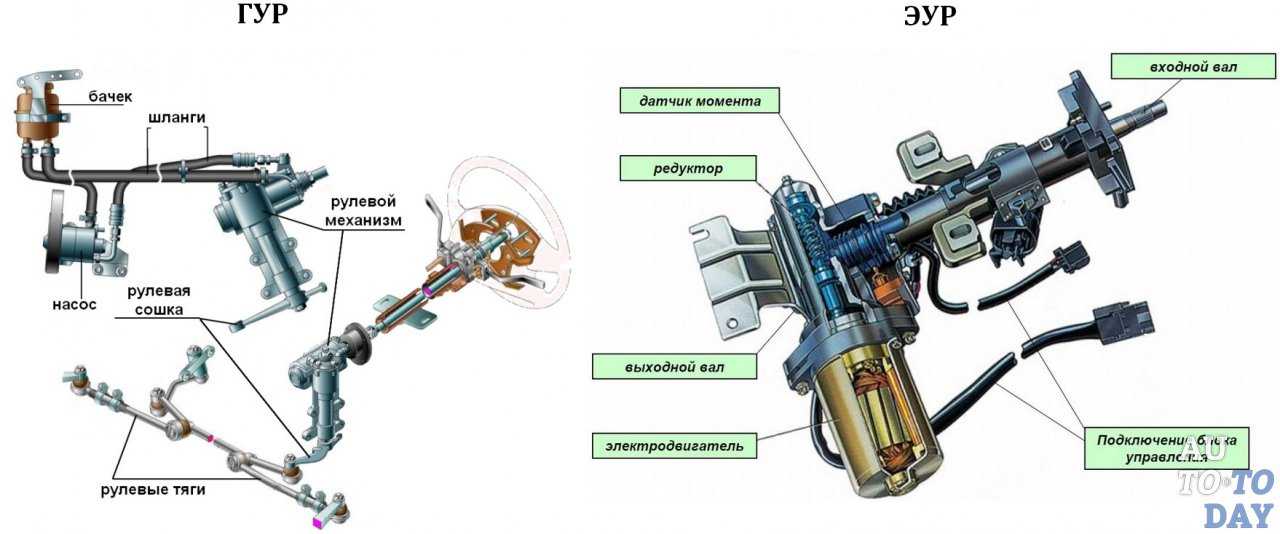 , Inc.
, Inc. 
 наполненные шприцы
наполненные шприцы  Прин, ООО
Прин, ООО 